Los seres vivos, a todos los niveles, tenemos la manía de impedir que los sistemas, sujetos a las leyes de la termodinámica, alcancen el equilibrio. Nos empeñamos en mantener un constante desequilibrio a costa de consumir energía. Este desequilibrio es el que hace posible aspectos fundamentales de la vida. Y las membranas celulares son críticas para ello.
Alrededor de las membranas de las células animales existe un desequilibrio entre el nivel de sodio que hay fuera y el que hay dentro, mientras que en las levaduras y plantas este desequilibrio se produce con iones de hidrógeno. La naturaleza tiende al equilibrio, por lo que a la mínima oportunidad que se les dé los iones tenderán a moverse de donde hay más a donde hay menos para igualar las concentraciones en las dos caras de la membrana y equilibrarse. Este tráfico espontáneo puede utilizarse para transmitir señales a través del axón de una neurona (el impulso nervioso) o para transportar otras moléculas que necesita la célula ya sea a favor de su concentración (canales) o en contra (transportadores), utilizando la energía del flujo de iones. Para mantener este desequilibrio la célula utiliza unas proteínas llamadas bombas. De la misma forma que una bomba de agua impulsa el preciado liquido en contra de la gravedad a costa de energía (electricidad, gasolina o tracción humana mediante una cuerda y una polea o una manivela) estas proteínas consumen energía de la célula para bombear iones en contra de su tendencia natural de igualar la concentración en las dos caras de la membrana. La energía la obtienen por mediación de una molécula llamada ATP. Las plantas además conservan una reliquia evolutiva que bombea iones utilizando pirofosfato como fuente energética. La importancia de estas proteínas se hace evidente si consideramos que el 50% de las proteínas de la membrana de un organismo como la levadura corresponden a estas bombas.
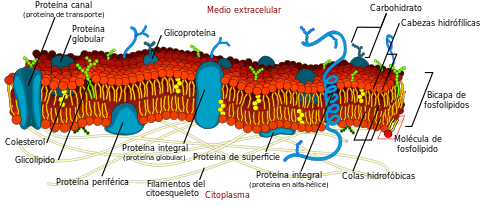
Esto no solo se aplica a la membrana celular. Dentro de la célula está la vacuola, o el lisosoma en animales, donde se produce el mismo desequilibrio, siempre con iones de hidrógeno, por eso su pH es más ácido que en el citoplasma celular.
Regular este desequilibrio es vital, puesto que si la célula no es capaz de regularlo tiene serios problemas o muere. El fallo genético de alguno de estos canales en humanos lleva a enfermedades que se las suele llamar “canalopatías”, donde se encuadran, entre otras, la fibrosis quística o la miotonía congénita.
Dado que el tráfico de iones a través de la membrana es esencial, tiene que estar regulado de tal manera que permita una respuesta eficaz en cada momento de forma casi instantánea ante cualquier cambio en el entorno de la célula.El desequilibrio se mantiene por proteínas, y también son proteínas las que sirven como canales y transportadores que aprovechan ese flujo de iones, por lo tanto, regulando a las proteínas clave, regularemos el desequilibrio, ¿cómo se puede regular una proteína?
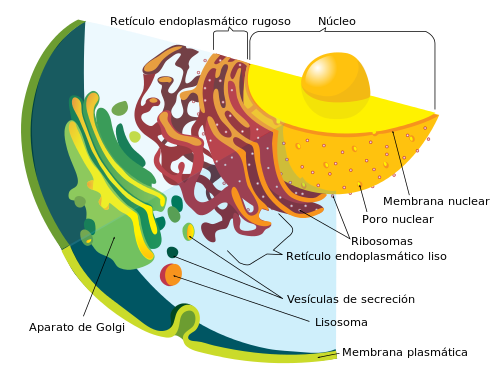
La forma mas normal es regulando al cantidad de proteína que hay. La información para hacer una proteína esta codificada en el ADN. Si hace falta más proteína, fabricas más, si hace falta menos, fabricas menos. Esto tiene el problema de que no es una respuesta rápida. Para empezar, si necesitas menos ¿Qué haces con la que ya has fabricado? Pero si necesitas más, tampoco es muy útil. Fabricar una proteína implica que se lea la información codificada en el ADN, que se copie en una molécula de ARN y que un ribosoma lo traduzca en proteína. Además, si la proteína está en una membrana, tiene que someterse a un proceso de tráfico y maduración. Las bombas de iones, como proteínas de membrana que son, se sintetizan en los ribosomas adosados al retículo endoplásmico. Tal y como se van traduciendo se integran dentro de la membrana del retículo endoplásmico, donde se pliegan para poder ser funcionales. Este paso es crítico. La célula tiene una maquinaria que si detecta un plegamiento incorrecto degrada la proteína. Y aquí empieza su viaje. El retículo endoplásmico produce unas vesículas que van al aparato de Golgi, y de ahí se producen otras vesículas que lo conducen a su destino final de la membrana plasmática o al lisosoma/vacuola. Cuando una proteína ya no hace falta en la membrana, o presenta problemas se degrada, pero no lo hace en la misma membrana. En la membrana plasmática se producen vesículas que van hacia la vacuola para degradar estas proteínas y reciclar sus componentes (los aminoácidos).
La célula es un ejemplo de pragmatismo. Dado que sintetizar una bomba de iones y llevarla a la membrana correspondiente es un proceso complejo, podemos regular este proceso para regular la función final de la proteína. En la célula existe una maquinaria dedicada a regular la degradación de proteínas. Cuando una proteína debe ser degradada, se le añade de forma covalente una proteína pequeña, llamada ubicuitina, que viene a ser como la marca negra de “La Isla del Tesoro”. No obstante, depende del tipo y donde se añade esta marca, el destino de la proteína es diferente. Puede añadirse una sola ubicuitina, una cadena de estas, o una sola, pero en diferentes sitios. Según el tipo de marca, el destino final de la proteína será diferente. Una forma de obtener una respuesta rápida es tener a la proteína circulando de síntesis a degradación rápidamente, de forma que si hace falta que se acumule mucha proteína, en muy poco tiempo, con desactivar la maquinaria de ubicuitinación consigues una respuesta rápida. Además podemos regular no de forma general, sino en localizaciones específicas de la membrana. Es tan fácil como solo frenar la ubicuitinación en una determinada área de la membrana. Incluso puede que no hace falta que se degrade. Algunos de las vesículas que se forman vuelven al Golgi, donde reciclan las proteínas que contienen para que vuelvan a la membrana plasmática.
No obstante, degradar una proteína es complejo. Los enzimas que degradan proteínas deben estar confinados para evitar que degraden otras proteínas. El truco que utiliza la célula es que el orgánulo especializado en esta degradación, el lisosoma/vacuola tiene un pH más ácido que el resto del interior celular. Si se escapara una enzima de degradación, no funcionaria por que no está a su pH óptimo. Además degradar una proteína que atraviesa la membrana presenta un problema topológico. La membrana tiene dos caras, si las vesículas solamente se fusionaran a la membrana del lisosoma/vacuola, solo se degradaría la cara interior. Para solucionar esto tenemos el complejo ESCRT. Este complejo de proteínas se encarga de seleccionar a las proteínas mono ubicuitinadas presentes en las vesículas, agruparlas en una parte determinada de la membrana y producir invaginaciones. Al final tenemos unas vesículas con vesículas por dentro, llamadas endosomas tardíos, cuerpos multivesiculares o compartimentos prevacuolares que cuando se fusionen con el lisosoma/vacuola volcarán todo su contenido en el interior donde serán degradados por los enzimas. Alternativamente estas vesículas pueden fusionarse con la membrana plasmática y vaciar las vesículas internas al medio exterior. Este sistema es uno de los predilectos para regular la degradación de las proteínas que transportan iones.
Cualquier sistema complejo puede dar lugar a fallos complejos. Problemas en alguna de las proteínas del complejo ESCRT puede dan lugar a enfermedades de diferente tipo, desde cánceres, a demencia frontotemporal o a enfermedades renales. Pero a veces puede ser peor. Hay virus que utilizan el complejo ESCRT para colarse dentro de la célula. Virus tan familiares como el del SIDA, el Ébola, o el tombusvirus de plantas secuestran el complejo ESCRT para replicarse e infectar otras células.
Por lo tanto, cuando acabes de leer este post, piensa que para que la señal de los ojos llegue al cerebro por el impulso nervioso, un montón de canales y bombas de iones se habrán activado y desactivado, sintetizado y degradado y muchas vesículas habrán repartido estos canales por todas las direcciones de la célula. Y luego dicen que la operación salida de vacaciones es compleja y causa problemas de tráfico.
Esta anotación recoge parte de las conclusiones del trabajo de revisión realizado por el laboratorio de Lynne Yenush con la colaboración del autor tal y como aparece en el artículo publicado en Current Genetics [footnote]Mulet J.M., Llopis-Torregrosa V., Primo C., Marqués M.C. & Yenush L. Endocytic regulation of alkali metal transport proteins in mammals, yeast and plants, Current Genetics, DOI: 10.1007/s00294-013-0401-2[/footnote]
Este post ha sido realizado por JM Mulet (@jmmulet) y es una colaboración de Naukas con la Cátedra de Cultura Científica de la UPV/EHU.
Tráfico, desequilibrios y bombas | NOTIC…
[…] Los seres vivos, a todos los niveles, tenemos la manía de impedir que los sistemas, sujetos a las leyes de la termodinámica, alcancen el equilibrio. Nos empeñamos en mantener un constante desequilibrio a costa de consumir energía. […]
Lo Mejor de la Semana (22-28 de septiembre) | Hablando de Ciencia | Artículos
[…] Tráfico, desequilibrio y bombas dentro de la célula. […]