Aunque se han desarrollado varios métodos para estudiar la química y la estructura de las proteínas, el reconocimiento y el mapeado de la estructura secundaria a escala nanométrica sigue siendo un reto importante. Ahora, un equipo de investigadores encabezado por Iban Amenabar, de CIC nanoGune, ha desarrollado una nueva técnica de espectroscopia infrarroja, llamada nano-FTIR, que permite obtener con una gran sensibilidad la identificación química de la estructura secundaria de las proteínas a escala nanométrica. Los resultados se publican en Nature Communications.
Las proteínas son los ladrillos básicos de la vida. La química y la estructura de las proteínas son esenciales para su función biológica. De hecho, la estructura de las proteínas determina sus propiedades mecánicas, además de las catalíticas en las enzimas. Tales funciones dan forma, literalmente, a todos los seres vivos. Además, la estructura de las proteínas también juega un papel importante en muchas enfermedades. Por ejemplo, la estructura secundaria de una proteína, si tiene una subestructura interna de hélice (alfa) o forma de hoja plegada (beta), podría ser importante en el proceso que desemboca en el alzhéimer, el párkinson y otras enfermedades neurodegenerativas.
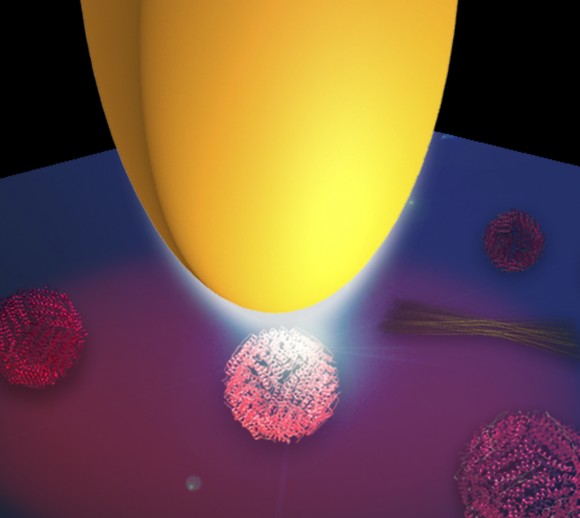
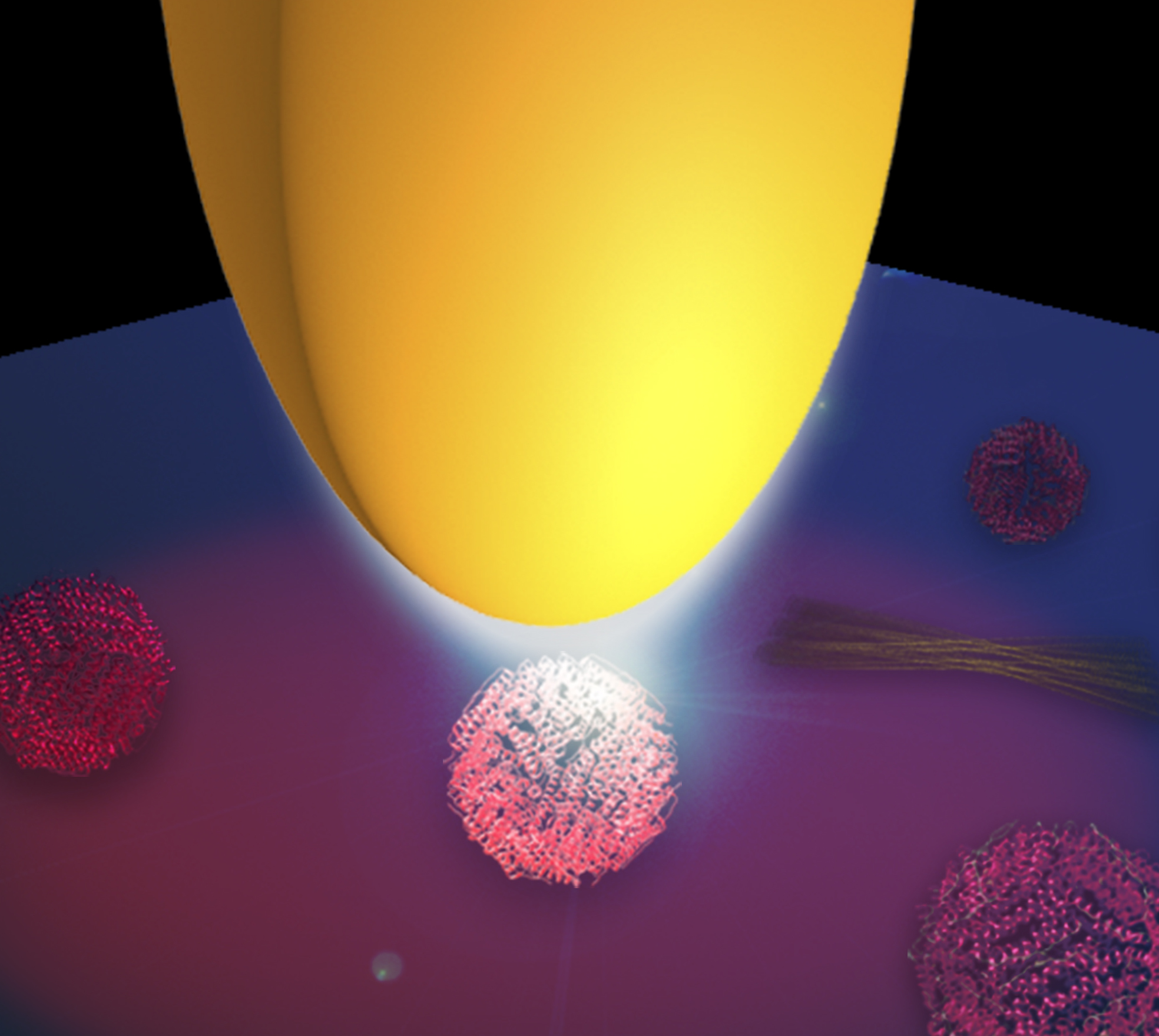
La nano-FTIR es una técnica óptica que combina la microscopía óptica de barrido de campo cercano (s-SNOM) con la espectroscopia infrarroja por transformada de Fourier (FTIR). Se trata de una herramienta que se usa habitualmente para estudiar la estructura secundaria de las proteínas que, sin embargo, no permite, por sí misma, realizar el mapeado de las proteínas a escala nanométrica. Para solventar este problema Amenabar et al han iluminando una punta metálica con un láser infrarrojo de banda ancha creando de esta forma un nanofoco que ilumina las proteínas. El análisis de la luz de reflejada por las proteínas con un espectrómetro de transformada de Fourier especialmente diseñado permite conseguir el espectro de las proteínas con una resolución espacial inferior a 30 nm. “La punta actúa como una antena para la luz infrarroja y la concentra en su vértice. El nanofoco en el vértice de la punta puede considerarse como una fuente de luz infrarroja ultrapequeña. Es tan pequeña que solamente ilumina una superficie de alrededor de 30×30 nm, que es la escala de los grandes complejos de proteínas”, dice el líder del proyecto Rainer Hillenbrand.
Con el fin de demostrar la versatilidad de la nano-FTIR en la espectroscopia de proteínas a escala nanométrica, los investigadores midieron los espectros infrarrojos de virus individuales, complejos de ferritina, membranas púrpuras y fibrillas de insulina. “Todos ellos presentan variaciones en la estructura secundaria —comenta Iban Amenabar, quien realizó los experimentos de nanoespectroscopia—; los virus y la ferritina están hechos, principalmente, de estructura hélice-alfa, mientras que las fibrillas de insulina están hechas, principalmente, de estructuras de hoja-beta”. Simon Poly, el biólogo del equipo, explica que “en una mezcla de fibrillas de insulina y algunos virus la espectroscopia de FTIR estándar no reveló la presencia de los virus hélice-alfa. Al sondear las nanoestructuras de las proteínas una por una con la técnica de nano-FTIR pudimos identificar claramente el virus, es decir, las estructuras con forma alfahelicoidal entre las de hojas-beta”.
Un aspecto relevante de gran importancia práctica es que el espectro del nano-FTIR es totalmente compatible con el espectro convencional del FTIR, mientras que la resolución espacial se ve incrementada por un factor de 100 comparada con la de la espectroscopia infrarroja convencional. “Podríamos medir los espectros infrarrojos de las partículas de ferritina individuales. Son complejos de proteínas de solo 24 proteínas. La masa de un complejo de ferritina es muy pequeña, solamente 1 attogramo, pero podríamos claramente reconocer su estructura hélice-alfa”, explica Amenabar.
Los investigadores estudiaron también las fibrillas de insulina individuales, que son un sistema de referencia para las enfermedades neurodegenerativas. Se conoce que las fibrillas de insulina tienen un núcleo de estructura de hoja-beta, pero su estructura completa todavía no está totalmente clara. “Gracias al espectro nano-FTIR de las fibrillas individuales reconocimos no solamente la estructura de hoja-beta, sino también estructuras de hélice-alfa que pueden resultar interesantes para la asociación de fibrillas” añade Alexander Bittner, líder del Grupo de Autoensamblaje de nanoGUNE.
“Estamos entusiasmados con las nuevas posiblidades que ofrece la nano-FTIR. Con puntas más afiladas y la función de antena mejorada, esperamos obtener espectros infrarrojos de proteínas individuales en el futuro. Vemos múltiples aplicaciones tales como el estudio de cambios conformacionales en las estructuras amiloides a nivel molecular, el mapeado de las modificaciones de las proteínas en nanoescala en tejido biomédico o el mapeado label-free de proteínas de membrana. Esto podría conducirnos a un nuevo campo de la nanobioespectroscopia infrarroja”, concluye Rainer Hillenbrand, líder del Grupo de Nanoóptica de nanoGUNE.
Referencia:
Amenabar I., Poly S., Nuansing W., Hubrich E.H., Govyadinov A.A., Huth F., Krutokhvostov R., Zhang L., Knez M. & Heberle J. & (2013). Structural analysis and mapping of individual protein complexes by infrared nanospectroscopy, Nature Communications, 4 DOI: 10.1038/ncomms3890
Edición realizada por César Tomé López a partir de materiales suministrados por la Oficina de Comunicación de CIC nanoGUNE / Gabinete de Prensa Elhuyar
‘In Focus’ sobre nanotecnología en la Biblioteca del Campus de Gipuzkoa « UPV/EHU Biblioteka
[…] de CIC nanoGUNE + Gabinete de Prensa Elhuyar | Cuaderno de Cultura Científica, 2013-12-30 https://culturacientifica.com/2013/12/30/como-determinar-la-estructura-secundaria-de-las-proteinas-us… CIC nanoGUNE: the Big Challenge of the Small Jose M. Pitarke | Basque Tribune, 2013-10-31 […]
Nanoteknologiari buruzko ‘In Focus’-a Gipuzkoako Campuseko Bibliotekan « UPV/EHU Biblioteka
[…] de CIC nanoGUNE + Gabinete de Prensa Elhuyar | Cuaderno de Cultura Científica, 2013-12-30 https://culturacientifica.com/2013/12/30/como-determinar-la-estructura-secundaria-de-las-proteinas-us… CIC nanoGUNE: the Big Challenge of the Small Jose M. Pitarke | Basque Tribune, 2013-10-31 […]