El espectrógrafo de masas es un instrumento electromagnético que separa iones en función de la relación (e/m) entre su carga (e) y su masa (m) y que permite el estudio de su masa y su naturaleza química.
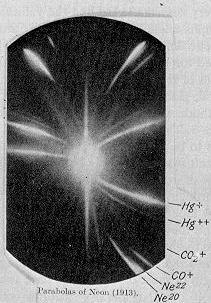
En 1912 Joseph John Thomson y su ayudante Francis Aston analizaban los rayos anódicos (una corriente de iones que pasa a través de un agujero en el cátodo de un tubo de descarga) cuando descubrieron un ion muy relacionado con el neón, de masa atómica 20, pero al que le correspondía una masa de 22. Durante varios años la identificación de este ion no terminaba de estar clara: no se estaba seguro de si era un compuesto, un nuevo elemento o una variante (isótopo) del neón. Sin embargo, desde 1913 Frederick Soddy lideró el bando de los que pensaban que se trataba de una demostración de la existencia de isótopos en los elementos no radioactivos.
El invento posterior del espectrógrafo de masas está íntimamente unido al concepto de isótopo de Soddy y al átomo de Rutherford-Bohr. Los primeros instrumentos, creados por Arthur Dempster en Chicago (1918) y Aston en Cambridge (1919), intentaban separar nítidamente los isótopos basándose en variaciones del aparato de Thomson para el estudio de los rayos anódicos. Pero fue el nombre de Aston, trabajando en el Laboratorio Cavendish de Cambridge que dirigía Ernest Rutherford, el que quedaría ligado al de espectrógrafo de masas.

Los dos instrumentos se basaban en dos técnicas de enfoque distintas y producían tipos de resultados diferentes.. En el espectrógrafo de Aston los campos eléctrico y magnético perpendiculares guiaban los iones de masa distinta a distintos puntos de una placa fotográfica. Aston identificó y midió los pesos atómicos de una enorme cantidad de isótopos; estableció la “regla del número entero” para los pesos atómicos (que dice que las masas isotópicas son múltiplos enteros del hidrógeno, en una época en la que se pensaba que solo existía un isótopo del hidrógeno de masa 1); y, con su segundo instrumento (1925), midió las desviaciones a la regla que el mismo había establecido, la “fracción de empaquetamiento” de los núcleos (una medida del equivalente en masa de la energía que une a las partículas que constituyen el núcleo). Por su trabajo recibió el premio Nobel de química de 1922. Los espectrógrafos de masas se usan mayoritariamente para la determinación de pesos atómicos con gran precisión.

Fue el instrumento de Dempster, sin embargo, y a pesar de que Aston se negó a llamarlo “espectrógrafo de masas” porque lo que medía era un espectro de momentos (masa por velocidad) y no puramente de masas, fue el que estableció la tradición de los espectrómetros de masas. En este diseño, un campo magnético perpendicular a un haz de iones hace que se muevan en una circunferencia cuyo radio depende de la masa y la velocidad de las partículas. En medio giro dentro de una cámara de vacío se pueden recoger los iones de igual masa·velocidad, mientras que los demás terminan estrellándose en las paredes de la cámara. Dempster usó un electrómetro de cuadrantes para medir cuantitativamente los iones en el receptáculo. Ajustando el potencial que aceleraba los iones pudo seleccionar diferentes iones y medir su abundancia relativa. Si bien fue incapaz de distinguir claramente entre los isótopos hipotéticos del magnesio y el cloro, Dempster abrió el camino para la determinación precisa de las abundancias, descubriendo muchos isótopos.
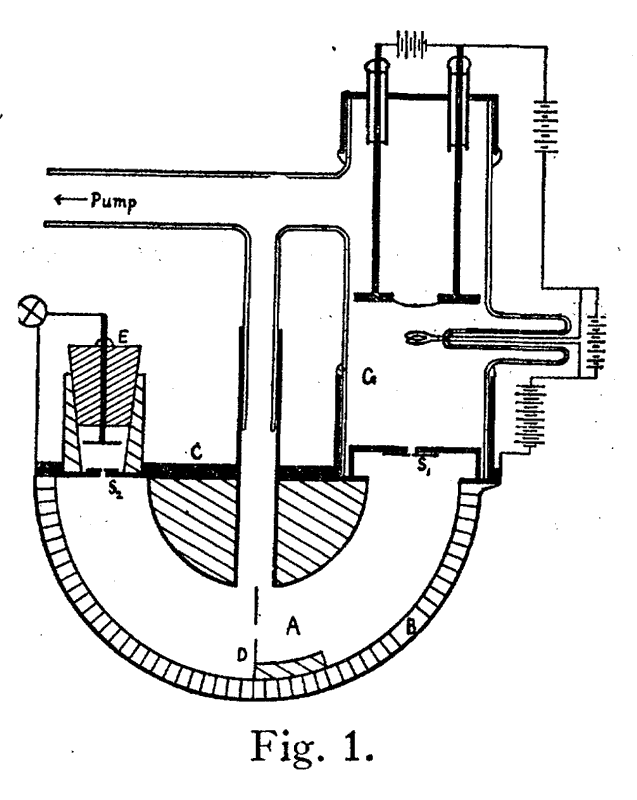
A partir de mediados de los años veinte se desarrollaron diferentes variaciones de espectrómetros de masas para cubrir las necesidades de los espectroscopistas, los químicos y los físicos. Los más importantes fueron el de Kenneth Bainbridge, quien aportó la primera prueba experimental de la famosa fórmula de Einstein E = mc2, y el de Alfred Neir, quien introdujo el analizador de 60º (sustituyendo al de 180º) en 1940.
En los años treinta y cuarenta se inventaron otros métodos para separar iones (tiempo de vuelo, radiofrecuencia, resonancia ciclotrónica, por nombrar algunos), los isótopos se convirtieron en algo fundamental en las ciencias físicas y el espectrómetro de masas se convirtió en un instrumento de análisis básico en cualquier laboratorio (incluidos los que se mandan a otros planetas).

En la serie Apparatus buscamos el origen y la evolución de instrumentos y técnicas que han marcado hitos en la historia de la ciencia.
Sobre el autor: César Tomé López es divulgador científico y editor de Mapping Ignorance
Esta anotación participa en la XLVII Edición del Carnaval de Química, cuyo blog anfitrión es ::ZTFNews.

Participaciones en la Edición XLVII Carnaval de Química | :: ZTFNews.org
[…] Así en la Tierra como en Marte: espectrógrafos y espectrómetros de masas por @EDocet participa desde el blog Cuaderno de Cultura […]
Resumen de la edición ‘Plata’ del Carnaval de Química… llega el ‘Cadmio’ | :: ZTFNews.org
[…] Así en la Tierra como en Marte: espectrógrafos y espectrómetros de masas por @EDocet participa desde el blog Cuaderno de Cultura […]