Decíamos al hablar del sistema de periodos que su regularidad, simetría y capacidad predictiva son indicios de que el modelo que explique la estructura de los átomos de los distintos elementos posee también estas características. Y, al hacerlo, dábamos por sentado que los átomos tienen estructura, algo que puede no parecer evidente. Merece la pena detenernos en este punto.
La química en el siglo diecinueve había tenido un éxito más que notable a la hora de explicar las proporciones de combinación de los distintos elementos y en la predicción de reacciones químicas. Tanto es así que buena parte de la revolución industrial fue la revolución químico-industrial. Este éxito terminó convenciendo a la mayoría de los científicos del último cuarto del siglo de que una hipótesis tan fructífera como la atómica indicaba claramente que la materia está compuesta en realidad de átomos. Pero este convencimiento suscitaba inmediatamente una pregunta relacionada: ¿Son los átomos realmente indivisibles, como se había supuesto, o consisten en partículas aún más pequeñas?
La pregunta surge de forma natural a poco que se piense un poco en el sistema de periodos. Recordemos que Mendeléyev había dispuesto los elementos siguiendo los criterios de masa atómica creciente y características químicas. Pero, y esto es importante, la única característica física del ordenamiento, las masas atómicas de los elementos, no pueden explicar las características químicas periódicas.
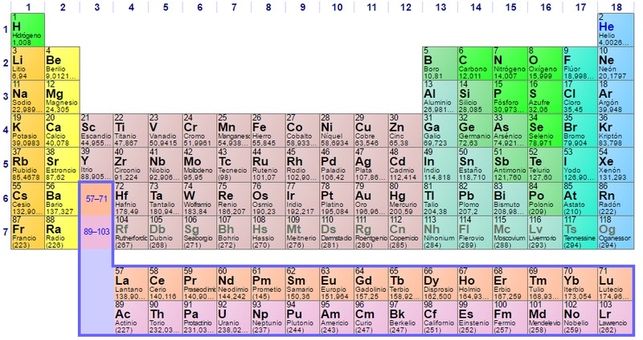
¿Por qué, por ejemplo, los elementos 3 (litio), 11 (sodio), 19 (potasio), 37 (rubidio), 55 (cesio) y 87 (francio) [1], con masas atómicas muy diferentes, tienen propiedades químicas similares (por ejemplo, arden, esto es, reaccionan rápida y violentamente, cuando se exponen al aire)? ¿Por qué estas propiedades son algo diferentes de las de los elementos 4 (berilio), 12 (magnesio), 20 (calcio), 38 (estroncio), 56 (bario) y 88 (radio) [2] de la lista (que reaccionan lentamente con el aire o el agua), pero son muy diferentes de las propiedades de los 2 (helio), 10 (neón) ,18 (argón), 36 (kriptón), 54 (xenón) [3] y 86 (radón) (que rara vez se combinan con cualquier otro elemento)?
La periodicidad en las propiedades de los elementos llevó a especular con la idea de que los átomos podrían tener una estructura, que podrían estar formados por piezas más pequeñas. Las propiedades cambian gradualmente de grupo a grupo. Este hecho sugiere que se puede agregar alguna unidad de estructura atómica de un elemento al siguiente, hasta que se complete una cierta porción de la estructura. Esta porción se encontraría completada en el átomo de un gas noble (Grupo 18). En un átomo del siguiente elemento más pesado, se iniciará una nueva parte de la estructura, y así sucesivamente.
Los métodos y técnicas de la química clásica no pudieron proporcionar pruebas experimentales para tal estructura. En el siglo XIX, sin embargo, los descubrimientos y las nuevas técnicas en física abrieron el camino para probar que los átomos en realidad consisten de piezas más pequeñas. [5]
La evidencia se fue acumulando para apoyar la conclusión de que los átomos de diferentes elementos difieren en el número y la disposición de estas piezas.
Notas:
[1] Descubierto por Marguerite Perey en 1939, no estaba en la tabla original de Mendeléyev.
[2] La primera noticia de la existencia del radio es de 1898 y la dieron Marie y Pierre Curie. El aislamiento del elemento se produjo en 1910 por Marie Curie y André-Louis Debierne.
[3] Todos los descubrimientos de los gases nobles son posteriores a la primera publicación del sistema de periodos de Mendeléyev. El primero, el helio, fue descubierto en 1868 como una línea en el esptectro de la cromosfera del Sol. Su aislamiento se produjo en 1897. El resto de elementos del grupo se aislaron entre 1894 y 1910.
[5] La existencia del electrón como unidad de carga eléctrica definido como la carga de un ion monovalente la propuso George Stoney en 1874 (el lo llamó electrolión). Incluso antes Richard Laming, en 1851, ya especuló con que los átomos eran un núcleo de materia rodeado de cargas eléctricas. Pero estos hechos no deben interpretarse como avances en el conocimiento de la estructura de los átomos (véase el título del libro de Laming). Nada hacía prever que la especulación de Laming resultase teniendo base, ni que los electrones fuesen a ser tan importantes. Sería presentismo atribuirles más significación de la que realmente tuvieron. La lógica real se sustenta en el armazón del sistema de periodos, como iremos viendo.
Sobre el autor: César Tomé López es divulgador científico y editor de Mapping Ignorance