
Como ocurre a menudo, el siguiente avance hacia la comprensión de la estructura atómica surgió de una investigación completamente sin ninguna relación con los espectros atómicos. La visión y el liderazgo de Ernest Rutherford hicieron que el equipo del Laboratorio Cavendish de la Universidad de Cambridge proporcionase durante el período 1909-1911 una nueva base sobre la que construir los modelos atómicos. Una base revolucionaria: los átomos son fundamentalmente espacio vacío.
Rutherford estaba interesado en los rayos emitidos por las sustancias radiactivas, especialmente los llamados rayos α (alfa). Estos rayos α consisten en partículas cargadas positivamente [1]. Algunas sustancias radiactivas emiten partículas α a velocidades y energías muy altas que pueden emplearse como proyectiles para bombardear muestras. Los experimentos que Rutherford y sus colegas hicieron con estas partículas son ejemplos de un tipo muy importante de experimento en física atómica y nuclear: el experimento de dispersión.
En un experimento de dispersión, un haz estrecho y paralelo de «proyectiles» (por ejemplo, partículas α, electrones o rayos X) se apunta a un objetivo. El objetivo suele ser una lámina delgada o una película de algún material. Cuando el rayo golpea el objetivo algunos de los proyectiles se desvían de su dirección original, dispersándose. La dispersión es el resultado de la interacción entre las partículas en el haz y los átomos del material. Un estudio cuidadoso de los proyectiles después de la dispersión puede generar información sobre los propios proyectiles, los átomos de la muestra y la interacción entre unos y otros. Así, si conocemos la masa, la energía y la dirección de los proyectiles y vemos como se dispersan podemos deducir las propiedades de los átomos que ocasionaron que los proyectiles se dispersasen de esa manera.
Rutherford notó que cuando un haz de partículas pasaba a través de una delgada lámina de metal, el haz se esparcía. Se puede pensar que esta dispersión está causada por interacciones electrostáticas entre las partículas α cargadas positivamente y las cargas que forman los átomos. Sabemos que los átomos contienen cargas positivas y negativas. Por lo tanto, una partícula α debería sufrir tanto fuerzas repelentes como atrayentes a medida que pasa a través de la materia. La magnitud y la dirección de estas fuerzas dependen de la distribución de las cargas en los átomos que constituyen la muestra y de la proximidad en cada momento de cada partícula a esas cargas. Cuando se propone un modelo atómico concreto, la extensión de la dispersión esperada se puede calcular y comparar con el experimento. Así, el modelo del átomo de Thomson predice una probabilidad casi nula de que una partícula se desvíe de su trayectoria inicial en un ángulo de más de unos pocos grados.
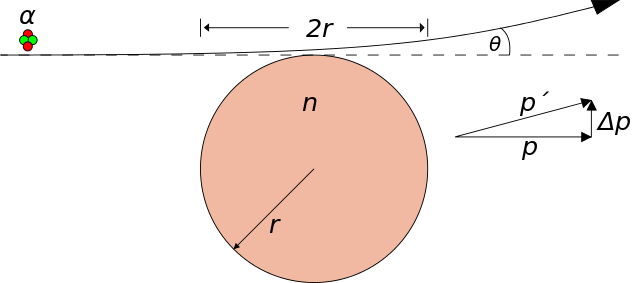
El avance que condujo al modelo moderno del átomo siguió al descubrimiento de uno de los ayudantes de Rutherford, Hans Geiger. Geiger descubrió que el número de partículas dispersadas en ángulos de 10 ° o más era mucho mayor que el número predicho por el modelo de Thomson. De hecho, increíblemente un número significativo de partículas α se dispersaba en un ángulo superior a 90 °, es decir, muchas partículas prácticamente rebotaban directamente desde la lámina. Según el modelo de Thomson, el átomo debería haber actuado solo ligeramente sobre el proyectil. Algunos años después, Rutherford escribiría [2]:
[. . .] Había observado la dispersión de partículas α, y el Dr. Geiger en mi laboratorio la había examinado en detalle. Descubrió, en piezas delgadas de metal pesado, que la dispersión era generalmente pequeña, del orden de un grado. Un día, Geiger vino a mí y me dijo: «¿No crees que el joven Marsden, a quien estoy enseñando métodos radiactivos, debería comenzar una pequeña investigación?» Resulta que yo también lo había pensado, así que dije: «¿Por qué no le dejas ver si alguna partícula α se dispersa con un ángulo grande? ”. Puedo decirle con confianza que no creía que ninguna lo hiciese, ya que sabíamos que la partícula α era una partícula masiva muy rápida, con una gran cantidad de energía [cinética], y se podía demostrar que si la dispersión se debía al efecto acumulado de varias dispersiones pequeñas, la posibilidad de que una partícula se dispersara hacia atrás era muy pequeña. Entonces recuerdo que dos o tres días después Geiger se acercó a mí muy excitado y me dijo: “Hemos podido hacer que algunas de las partículas vuelvan atrás. . . »
Fue lo más increíble que me ha sucedido en mi vida. Fue casi tan increíble como si dispararas un proyectil de 15 pulgadas [3] contra un trozo de papel de seda y volviera y te golpeara. Reflexionando, me di cuenta de que esta dispersión hacia atrás debía ser el resultado de una sola colisión, y cuando hice los cálculos vi que era imposible obtener algo de ese orden de magnitud a menos que tomaras un sistema en el que la mayor parte de la masa del átomo se concentraba en un núcleo diminuto. Fue entonces cuando tuve la idea de un átomo con un centro masivo diminuto, con una carga.
Estos experimentos y la interpretación de Rutherford marcaron el origen del concepto moderno del átomo nuclear. Pero, pensemos un momento. A la vista de lo que hemos visto, ¿por qué el átomo debería tener su masa y carga positiva concentradas en un pequeño núcleo en el centro alrededor del cual se agrupan los electrones? Necesitamos más datos para poder llegar nosotros a esa conclusión también.
Notas:
[1] Estas partículas α son iones de helio cargados positivamente o, si se prefiere, núcleos de helio, con masas aproximadamente 7500 veces la masa del electrón.
[2] Rutherford, E. (1936) “The Development of the Theory of Atomic Structure”, publicado en “Background to Modern Science” McMillan, New York, 1940. Traducción propia.
[3] Un señor obús de 38,1 cm de diámetro. Véase la imagen que encabeza el texto.
Sobre el autor: César Tomé López es divulgador científico y editor de Mapping Ignorance

El modelo atómico de Rutherford — Cuaderno de Cultura Científica
[…] de que el átomo debía tener una concentración de masa y carga, esto es, un núcleo a partir de los primeros experimentos de Geiger y Marsden? Veámoslo con algo más de detalle partiendo de la base de que el modelo imperante en ese momento […]
El modelo atómico de Rutherford – Fluceando
[…] de que el átomo debía tener una concentración de masa y carga, esto es, un núcleo a partir de los primeros experimentos de Geiger y Marsden? Veámoslo con algo más de detalle partiendo de la base de que el modelo imperante en ese momento […]
El tamaño del átomo de hidrógeno — Cuaderno de Cultura Científica
[…] entrada estaban los órdenes de magnitud impuestos por los resultados de dispersión obtenidos por el laboratorio de Rutherford. De ellos se podían deducir algunas cosas interesantes. Para empezar, el tamaño aproximado del […]
¿Por qué los átomos tienen el tamaño que tienen? — Cuaderno de Cultura Científica
[…] átomos en realidad están compuestos principalmente de espacio vacío. En el centro de cada átomo hay un núcleo muy pequeño, en el que se concentra toda la carga […]
El núcleo atómico — Cuaderno de Cultura Científica
[…] nuestra introducción a los átomos vimos que los experimentos indicaban que el átomo consiste en un núcleo diminuto, cargado positivamente, rodeado de electrones cargados negativamente. Los experimentos sobre la […]
Rayos alfa, beta y gamma — Cuaderno de Cultura Científica
[…] 1899, Ernest Rutherford, en lo que serían los primeros pasos de lo que después resultaría en su teoría del átomo nuclear, comenzó a buscar respuestas a esta pregunta. Rutherford descubrió que una muestra de uranio […]
Tres modelos atómicos de los que no has oído hablar — Cuaderno de Cultura Científica
[…] experimentos de Geiger y Marsden de 1909 con el pan de oro dieron una primera confirmación experimental al modelo de Nagaoka. En el […]