Científicos, animalistas y el uso de animales para investigación
Mucho se ha hablado de los animales utilizados en investigación. Valga como ejemplo esta estupenda revisión sobre el tema realizada por el investigador Lluís Montoliu o el informe Confederación de Sociedades Científicas de España (COSCE). El tema del uso de animales para fines científicos salta a la palestra periódicamente por presiones del lobby animalista, el cual, sin lugar a dudas, ha influido en las leyes y normas vigentes. Por parte de la razón, es decir, de la ciencia, existe una defensa férrea del uso de animales para investigación, ya que, sin su utilización, no podríamos acometer las nuevas aproximaciones terapéuticas y diagnósticas que necesitamos para poder combatir las enfermedades que todavía hoy no tienen solución y que necesitamos para mejorar la vida de los enfermos. Así que existe un enconado desencuentro entre científicos y animalistas sobre el uso de animales para fines científicos. Sin embargo, hay una entidad, o grupo de entidades, en los que no cabe debate alguno.

La talidomida fue prescrita y utilizada entre los años 1957 y 1963 en Europa. Hasta ese momento ningún país europeo contaba con regulación alguna sobre el uso de medicamentos, por lo que la tragedia de este fármaco produjo un verdadero terremoto en el desarrollo de medicamentos en el viejo continente. Alemania, un país particularmente afectado por el caso de la talidomida, tuvo que aprobar con urgencia en el año 1961 la primera ley que regulaba el uso de medicamentos.
Hasta ese momento la responsabilidad de evaluar los medicamentos recaía sobre los propios fabricantes. Aunque su distribuidor, Grünenthal, realizó algunos experimentos de seguridad, estos no fueron suficientes para detectar los efectos secundarios del fármaco, y en ninguno de los casos se evaluó el fármaco en animales gestantes. En aquellos años tampoco era obligatorio evaluar los medicamentos en animales en periodo de gestación en el Reino Unido, pero de nuevo la catástrofe de la talidomida propició que se formara en 1964 el Comité de Seguridad de Medicamentos y que, cuatro años más tarde, se promulgara la primera Ley del Medicamento británica.

Hoy en día todos los países de primer orden cuentan con agencias para el control del desarrollo, liberación y evaluación de nuevos medicamentos. Es el caso de la European Medicines Agency (EMA) en Europa o la Food and Drug Administration (FDA) en los Estados Unidos. Dichas organizaciones se encargan de velar por la seguridad de los fármacos que se prueban en humanos. La única obsesión de dichas agencias es que no se vuelva a dar un “caso talidomida”. Así que solicitan que se realice un estudio completo y pormenorizado de la toxicidad de los fármacos bajo estudio, y siempre antes de autorizarlos para su uso en humanos. La eficacia del medicamento se supone; de lo que se encargan las correspondientes agencias es de que los fármacos sean suficientemente inocuos.

Las agencias reguladoras obligan a la industria farmacéutica a realizar una exhaustiva batería de estudios para conocer cómo los fármacos afectan a diferentes sistemas del organismo y a procesos patológicos críticos, determinando sus rangos de su seguridad en el mejor de los casos (en el peor y más habitual el desarrollo de los nuevos fármacos es interrumpido por estas cuestiones).
Veamos un ejemplo concreto de los estudios requeridos por las autoridades:
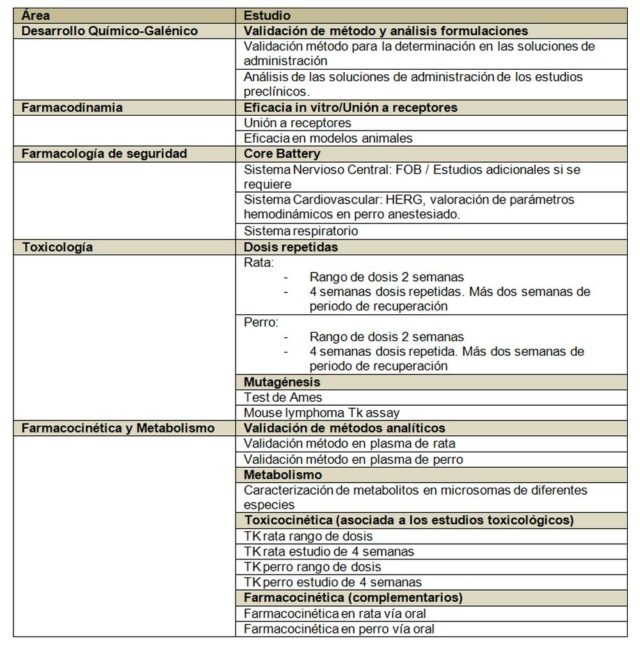
Podemos observar en la tabla anterior, grosso modo, los estudios que las agencias exigen. Hagamos algunas apreciaciones al respecto:
- La tabla refleja los estudios mínimos necesarios, los cuales pueden no ser suficientes si se encuentra algún hallazgo patológico inesperado, cosa que suele ocurrir ya que se fuerzan las dosis hasta encontrar efectos secundarios, lo cual permite definir las dosis de trabajo. Aquí es necesario recordar a Paracelso, que ya explicó la importancia de las dosis hace casi 500 años.
- El paquete básico de estudio está por encima del medio millón de euros en prácticamente todos los casos y los estudios tienen una duración de un año al menos. Esto si las cosas van bien, claro. En muchas ocasiones los tiempos y los costes se incrementan.
- Los laboratorios que realizan este tipo de estudios deben estar certificados en Buenas Prácticas de Laboratorio (BPL; o GLP en inglés), por lo que lo realizan exclusivamente empresas especializadas llamadas Contract Research Organizations (CRO). Todos los protocolos de estudios están normalizados y acordados, y hay que seguirlos estrictamente, registrando cualquier desviación detectada.
- Se estudian los principales sistemas del organismo, tales como el sistema respiratorio, cardíaco o nervioso, así como procesos que puedan afectar a la seguridad, tales como la mutagénesis o los estudios de interacción con receptores.
- Se estudian dos especies animales siempre; una de roedores y otra de no roedores. Por cuestiones históricas la especie de roedor mayoritaria es la rata (el ratón no se usa para estudios regulatorios normalmente). Las agencias tienen un amplio recorrido de estudios realizados en rata y pueden comparar expedientes. La especie no roedora suele ser el perro, aunque se pueden utilizar otros no roedores con su justificación pertinente. Sólo en contadas ocasiones las agencias autorizan el uso de primates. El perro habitualmente usado para estos estudios es de la variedad Beagle; los monos suelen ser macacos.
- Toda la información extraída de los estudios regulatorios preclínicos es utilizada para diseñar los estudios en humanos First-in-human, y las primeras dosis de estudio vienen definidas por la dosis anterior a la más baja que produce algún efecto en cualquiera de las dos especies animales utilizadas en los estudios. A esta dosis se le conoce como NOAEL (de non-observed adverse effect level).
- Previamente a los estudios en humanos se aplicará un factor de dilución a la dosis elegida como medida adicional de seguridad. La dosis final que será utilizada para iniciar los estudios en humanos es lo que se conoce como MRSD (del inglés máximum recommended starting dose).

A grandes rasgos, para todo lo anteriormente expuesto, es necesario el uso de animales. Y en este caso el factor limitante no son los comités de ética, que los hay, si no la cuantía económica de los estudios y la duración de los mismos (para la empresa farmacéutica, tiempo y dinero son parámetros esencialmente equivalentes).
La pregunta ahora es: ¿Cuántos animales se usan para este tipo de estudios en nuestro país? Si analizamos el último informe oficial publicado por el Ministerio de Agricultura, Pesca, Alimentación y Medio Ambiente (MAPAMA), el número de animales utilizados en 2016 para fines científicos fueron los siguientes:
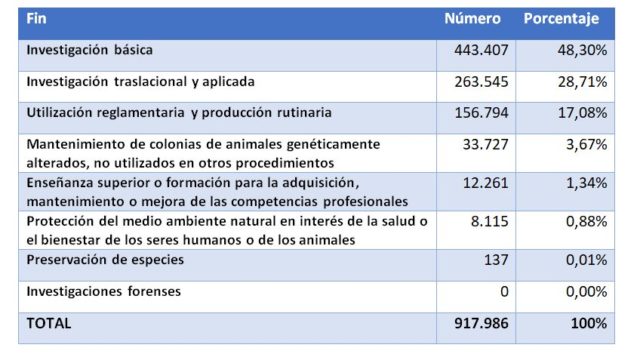
Es decir, que la mayoría de animales fueron usados para investigación (básica o traslacional/aplicada, en un 77%). La siguiente partida en importancia es la utilización reglamentaria y producción rutinaria. Si atendemos sólo al uso reglamentario los datos indican que se utilizaron 49.640 animales para este fin repartidos de la siguiente forma:
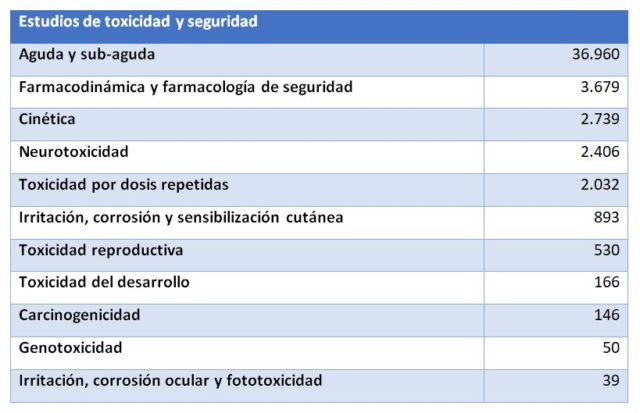
Es decir, de cada 100 animales utilizados para fines científicos aproximadamente 5 fueron sacrificados por cuestiones regulatorias, por los 75 que fueron usados en las diferentes fases de investigación. Tal vez 50.000 animales al año para estudiar la seguridad de los fármacos pueda parecer mucho, tal vez no parezca tanto si lo comparamos con las incontables personas que sufrieron el efecto de la talidomida en nuestro país.
Si salimos de nuestra zona de confort y atendemos, por ejemplo, al uso de animales para la alimentación, según Eurostat sólo en 2015 se sacrificaron más de 46 millones de cerdos en España. O lo que es lo mismo, un cerdo por español. Por el contrario, en 2015 por cada español tan sólo se usaron 0,018 animales con fines regulatorios. Juzguen ustedes mismos.
Este post ha sido realizado por Javier Burgos (@Javisburgos) y es una colaboración de Naukas con la Cátedra de Cultura Científica de la UPV/EHU.
Referencias y más información
- Lluís Montoliu (2018) ¿Cuántos animales se usan en España para experimentación? Cuaderno de Cultura Científica
- Informe COSCE sobre el uso de animales de investigación.
- Informe 2016 de uso de animales para investigación del MAPAMA. [PDF]
- Guía de desarrollos preclínicos. Genoma España. [PDF]

Lo Mejor de la Semana (22 – 28 de abril) | Hablando de Ciencia
[…] Y terminamos la semana con un artículo que merece la pena leer con atención y luego reflexionar: científicos, animalistas y el uso de animales para investigación. […]
Hitos en la red #213 | Enlace Recomendado | Naukas
[…] Este es un debate en el que abundan desinformación y prejuicios. Javier Burgos intenta aportar algo de objetividad: Científicos, animalistas y el uso de animales para investigación […]
Cas típic 2827: noi li agrada noia, noi li agraden els forats negres | Pons's blog
[…] El us dels animals en investigació científica […]
Moral y mercados — Cuaderno de Cultura Científica
[…] se crían ratones de laboratorio con alguna característica especial (transgénicos, mutantes en algún gen, o cualquier otra) y si, […]