Niosomas como vectores de terapia génica del sistema nervioso central
La terapia génica es una técnica con un enorme potencial en pleno desarrollo. Consiste, básicamente, en introducir material genético en las células diana con tres fines posibles: crear una nueva función, restablecer una función defectuosa o interferir con una función ya existente. Una de las principales dificultades que presenta la técnica es, precisamente, “conseguir vehiculizar ese material genético nuevo a la célula. En el caso del sistema nervioso, esa transfección es especialmente complicada, debido, entre otros factores, a las barreras físicas que tiene el cerebro y que deben ser superadas”, explica Gustavo Puras, miembro del grupo NanoBioCel de la Facultad de Farmacia de la UPV/EHU y uno de los autores del estudio.
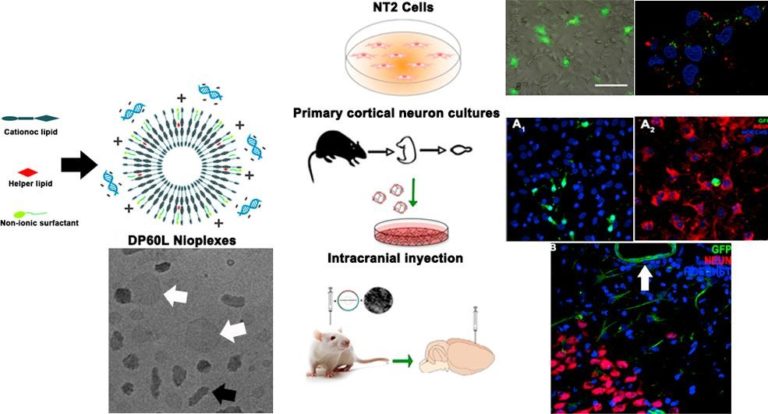
Este grupo de investigación se centró un tipo de vectores no-virales, los niosomas. “Son unas partículas lipídicas, unas vesículas, formadas por tres componentes: un lípido catiónico, que es el responsable de unirse al ADN que se quiere introducir en las células diana; otro lípido auxiliar, que favorece la entrada al núcleo a través de la membrana y evita la degradación del niosoma por parte de los lisosomas celulares, y un tensioactivo no iónico, que estabiliza la emulsión que se emplea en el manejo de estas partículas”, añade el doctor Puras.
El estudio tuvo diferentes fases. En la primera se seleccionaron los tres componentes con los que diseñar la propia partícula del niosoma. La parte novedosa de este estudio, tal como relata Puras, es que “utilizamos como lípido auxiliar el licopeno, el pigmento que da color a los tomates, que es conocido por tener propiedades para el tratamiento contra el cáncer y enfermedades cardiovasculares, pero no se había estudiado su posible rol en terapia génica”. Después, unieron al niosoma un plásmido, un gen, que en su caso fue el gen de la proteína verde fluorescente. “No es un plásmido terapéutico, pero nos sirvió para saber si las células eran transfectadas o no, porque en caso afirmativo emitirían fluorescencia verde”.
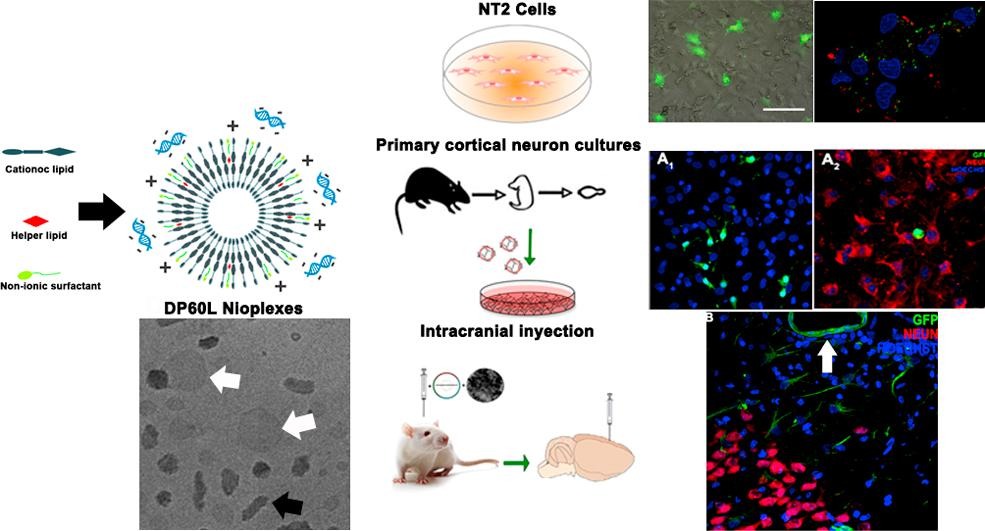
Una vez conseguido el complejo niosoma-plásmido, y realizada la caracterización físico-química, hicieron pruebas in vitro con modelos de células neuronales para ver la tasa de transfección, es decir, el porcentaje de células verdes fluorescentes conseguido, y la viabilidad de estas células transfectadas. “Lo que vimos fue que la incorporación del licopeno a la formulación mejoró la transfección de estas neuronas”.
En una última fase, “la más interesante”, realizaron pruebas in vivo inyectando los niosomas en el encéfalo de ratas. Lo que pudieron ver fue que las principales células que se transfectaron “no fueron neuronas, sino células gliales y células de las paredes de los vasos sanguíneos. No son neuronas, pero también son importantes, y se dividen más; por eso las hemos conseguido transfectar en mayor proporción”.
El investigador se muestra “muy satisfecho” con los resultados obtenidos: “Lo que buscábamos era conseguir transfectar células del sistema nervioso central, y lo hemos conseguido. En un paso posterior, el gen que transfectemos no será el de la proteína verde fluorescente, sino alguna proteína que produce agentes bioactivos, o agentes que favorezcan la revascularización. Las células que resultaron transfectadas en mayor medida, las células gliales, son muy abundantes en el sistema nervioso central, y juegan un papel crucial en el correcto desarrollo y funcionamiento del tejido nervioso. Además, su alteración está asociada con numerosos desórdenes neurológicos, como los derrames cerebrales, la esclerosis múltiple, la epilepsia, el alzhéimer y el párkinson”.
Referencia:
Mohamed Mashala, Noha Attia, Cristina Soto-Sánchez, Gema Martínez-Navarrete, Eduardo Fernández, Gustavo Puras, José Luis Pedraz (2018) Non-viral vectors based on cationic niosomes as efficient gene delivery vehicles to central nervous system cells into the brain International Journal of Pharmaceutics doi: 10.1016/j.ijpharm.2018.09.038
Edición realizada por César Tomé López a partir de materiales suministrados por UPV/EHU Komunikazioa