El citoesqueleto de las neuronas y el alzhéimer
José Martínez Hernández, investigador Ikerbasque del grupo Neuronal Ubiquitin Pathways del Departamento de Bioquímica y Biología Molecular de la Facultad de Ciencia y Tecnología de la UPV/EHU, ha participado en un estudio del Instituto de Neurociencias de Grenoble, en el que han descubierto la relación existente entre la presencia de péptidos beta-amiloide, conocidos por ser los componentes de las placas que se acumulan en el cerebro de las personas afectadas de alzhéimer, y la rápida pérdida de dinamismo del citoesqueleto de actina de las espinas dendríticas, las zonas de las neuronas encargada de recibir la información que viene de otras neuronas mediante sinapsis. Esta menor dinámica hace que la transmisión de la información no sea eficiente, lo que desemboca en la pérdida de las espinas y, por tanto, de la capacidad de formación de sinapsis de las neuronas.
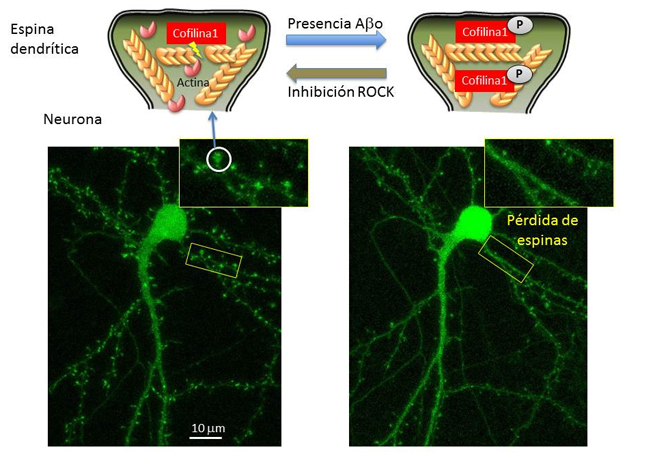
El citoesqueleto es un entramado tridimensional de proteínas que provee de soporte interno a las células, organiza sus estructuras e interviene procesos como el transporte o el tráfico intracelular. Uno de los componentes del citoesqueleto son los filamentos de actina, que, tal como describe el doctor Martínez, “están ancladas pero en continuo movimiento, como si fueran una escalera mecánica; una proteína, llamada cofilina 1, se encarga de cortar los filamentos, y separar las unidades de actina, lo que mantiene activa esa dinámica”.
Sin embargo, en el caso de que la cofilina 1 sea fosforilada, es decir, se le añada un átomo de fósforo, esta proteína pasa a un estado inactivo, y deja de ejercer su función, lo que, a su vez impide que se lleve a cabo correctamente la actividad neuronal. “En nuestro estudio analizamos muestras de cerebros humanos con alzhéimer así como modelos animales de esta enfermedad, y en ellos vimos que la forma inactiva de la cofilina 1 aparecen en cantidades mayores que en neuronas sanas”.
En cultivos de neuronas vieron que la exposición a péptidos de beta-amiloide, el principal componente de las placas o depósitos que se acumulan en el cerebro de las personas con alzhéimer, provoca el aumento de la cofilina 1 fosforilada, y por tanto, provoca que se estabilicen demasiado los filamentos de actina, que pierdan dinamismo y altere el funcionamiento de las espinas dendríticas. “A largo plazo, además, los péptidos beta-amiloide hacen que haya menos espinas; al dejar de ser funcionales, se van perdiendo a lo largo del tiempo”, subraya el investigador
Una de las vías de fosforilación de la cofilina 1 es la ROCK, una quinasa, un tipo de enzima que modifica otras moléculas mediante fosforilación, a veces activándolas y otras desactivándolas. En el estudio quisieron ver si un medicamento que se utiliza en la práctica clínica, el Fasudil, cuya función es inhibir la acción de la enzima ROCK, revertía el efecto observado en los filamentos de actina, y “vimos que sí. No hemos propuesto un mecanismo de acción, pero hemos comprobado que la inhibición de esa vía de fosforilación de la cofilina 1 hace que la exposición a péptidos beta-amiloide no provoque la inactivación de la proteína, y el consecuente efecto en el citoesqueleto de las espinas dendríticas”, detalla Martínez.
“Nuestros resultados apoyan la idea que el daño provocado por los péptidos beta-amiloides a nivel de las espinas dendríticas en las primeras fases de la enfermedad puede prevenirse con la modulación de ROCK y la cofilina1, y que, por tanto, es necesaria la investigación en medicamentos que detengan esta fosforilación de manera específica de la cof1 en neuronas, para elaborar futuros tratamientos médicos contra el mal de Alzheimer”, concluye el doctor Martínez.
Referencia:
Travis Rush, Jose Martinez-Hernandez, Marc Dollmeyer, Marie Lise Frandemiche, Eve Borel, Sylvie Boisseau, Muriel Jacquier-Sarlin, Alain Buisson (2018) Synaptotoxicity in Alzheimer’s disease involved a dysregulation of actin cytoskeleton dynamics through cofilin 1 phosphorylation The Jounal of Neuroscience (2018) doi: 10.1523/JNEUROSCI.1409-18.2018
Edición realizada por César Tomé López a partir de materiales suministrados por UPV/EHU Komunikazioa