La microglía es un sensor de mortalidad neuronal
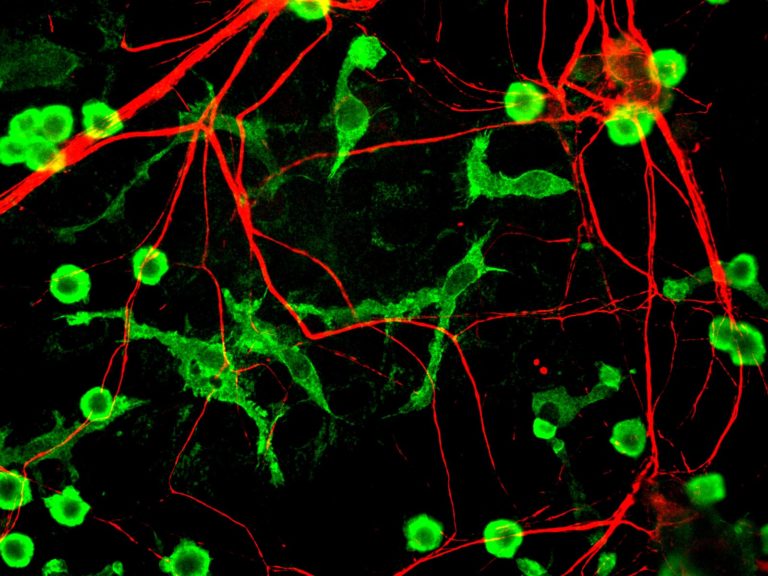
La muerte neuronal, que generalmente asociamos al envejecimiento del cerebro y las enfermedades neurodegenerativas, también afecta a las neuronas jóvenes. Las neuronas recién nacidas mueren de manera frecuente durante el desarrollo del cerebro de manera programada, controlada mediante un mecanismo de suicidio celular llamado “apoptosis”. Para evitar convertirse en un cementerio, el cerebro tiene un mecanismo muy eficaz de eliminación de cadáveres: las células de microglía. La microglía, descubierta hace 100 años por el vallisoletano Pío del Río Hortega, es la encargada de “comerse” las células muertas mediante el proceso de “fagocitosis”.
Sin embargo, la fagocitosis no es simplemente la retirada pasiva de residuos para evitar el daño de las neuronas circundantes, como demuestra un estudio internacional liderado por Jorge Valero y Amanda Sierra, del centro vasco de neurociencias Achúcarro, la fundación Ikerbasque, y la Universidad del País Vasco UPV/EHU. Por el contrario, la fagocitosis de neuronas muertas es un proceso activo que repercute directamente en la salud y la función de las neuronas supervivientes.
Del mismo modo que tras la muerte de una cebra en la sabana, los buitres y otros carroñeros eliminan el cadáver, y sus deposiciones sirven para nutrir el suelo y que crezcan plantas que alimentan a otras cebras, la microglía también cierra el ciclo vital de las neuronas.
Para estudiar este proceso, los investigadores se centraron en la producción de nuevas neuronas o neurogénesis, que se produce en un área del cerebro adulto muy importante para los procesos de memoria y aprendizaje, el hipocampo. En esta región, la mayor parte de las neuronas recién nacidas se suicida a los pocos días de nacer, y son inmediatamente englobadas y eliminadas por la microglía. La primera pista de que el proceso de fagocitosis participaba de manera activa en la regulación de la neurogénesis la obtuvo el investigador del grupo Iñaki París, que utilizó distintos modelos genéticos de bloqueo de la fagocitosis proporcionados por colaboradores del Instituto Salk en California y del Instituto de Medicina Experimental de Budapest. En estos ratones, la reducción de la fagocitosis de células apoptóticas estaba acompañada de cambios en la producción de nuevas neuronas, lo que sugería la existencia de algún tipo de señal de comunicación entre la microglía fagocítica y las células recién nacidas.
La respuesta a esta hipótesis la obtuvo la investigadora del grupo Irune Díaz-Aparicio. Utilizando un modelo en cultivo en el que la microglía era “alimentada” con células apoptóticas, observó que lejos de ser un proceso pasivo de retirada de residuos, la fagocitosis era en realidad un proceso extraordinariamente activo y que alteraba a la microglía en todos los niveles, desde genéticos hasta metabólicos. Parte de estos cambios implicaban al secretoma, que es el conjunto de moléculas secretadas o liberadas por la microglía fagocítica, y que contenía señales que instruían a las células recién nacidas para continuar dividiéndose o diferenciarse en neuronas. Este secretoma era la señal entre la microglía fagocítica y las células recién nacidas en el hipocampo, y es por tanto el responsable de cerrar el ciclo vital de las neuronas.
Los investigadores proponen por tanto que la microglía actúa como un sensor de mortalidad. Cuando la microglía detecta mucha muerte de células recién nacidas indica al sistema de producción de neuronas que se están generando demasiados excedentes y debe frenar la producción. Por el contrario, cuando detecta pocas muertes, el hipocampo podría admitir más neuronas nuevas y se ha de retirar el freno. Por tanto, la conclusión principal de este estudio es que la microglía fagocítica ayuda a frenar la producción de nuevas neuronas mediante su secretoma contribuyendo al equilibrio entre vida y muerte.
Estos estudios tienen importantes implicaciones para nuestra comprensión de cómo se defiende el cerebro ante la muerte neuronal en el envejecimiento y las enfermedades neurodegenerativas, como la enfermedad de Alzheimer, la de Parkinson, el infarto cerebral o la epilepsia. En estas enfermedades, potenciar la fagocitosis puede ser una nueva estrategia neuroprotectora, no solamente para acelerar la limpieza del tejido de los restos de células muertas, si no para que el secretoma de la microglía contribuya a regenerar el tejido dañado.
Referencia:
Irune Diaz-Aparicio, Iñaki Paris, Virginia Sierra-Torre, Ainhoa Plaza-Zabala, Noelia Rodríguez-Iglesias, Mar Márquez-Ropero, Sol Beccari, Paloma Huguet, Oihane Abiega, Elena Alberdi, Carlos Matute, Irantzu Bernales, Angela Schulz, Lilla Otrokocsi, Beata Sperlagh, Kaisa E. Happonen, Greg Lemke, Mirjana Maletic-Savatic, Jorge Valero and Amanda Sierra (2020) Microglia actively remodel adult hippocampal neurogenesis through the phagocytosis secretome
Edición realizada por César Tomé López a partir de materiales suministrados por UPV/EHU Komunikazioa