Una escala de pH para el mundo real

El pH es un índice omnipresente: desde la publicidad cosmética hasta el estado de la piscina. Es una escala sencilla, y cualquiera puede determinar el valor de una muestra fácilmente en caso de necesidad. Incluso el concepto no es demasiado complicado, bastan las matemáticas y la química de secundaria para tener una idea bastante precisa.
Pero lo que está bien para un ciudadano medio puede no estarlo para un científico. Hace unos años un divulgador de fama mundial publicaba un artículo sobre organismos extremófilos en entornos de acidez extrema, con valores de ph negativos. Una microbióloga de fama también mundial en los comentarios llamó la atención sobre lo que ella consideraba un error, los pHs negativos.
Increíble, pero cierto. Porque los pHs negativos existen, por definición de pH.
Hechos como este hacen que uno se cuestione sobre el nivel de formación química elemental de algunos personas con títulos universitarios: desde graduadas en medicina que prescriben homeopatía (cuyo mero concepto es incompatible con la existencia de los átomos), por ejemplo, a microbiólogas de renombre, como hemos visto. Como, a fin de cuentas, esto es algo que no podemos remediar en su conjunto, vamos a intentar explicar el concepto de pH que debería conocer, no ya un científico, sino un ciudadano informado, y más que nada por si alguien lo busca en Internet, siguiendo la filosofía educativa de según qué ministres. Para ello haremos un repaso más o menos formal sobre el concepto habitualmente admitido, luego nos iremos al fútbol y finalmente veremos como nos queda la definición de pH.
Un poco de historia
Svante Arrhenius fue un químico sueco al que habitualmente se le atribuye la idea de que las moléculas en disolución acuosa se disocian en sus iones (esto es discutible; Max Planck, de fama cuántica, tendría algo que decir, pero esta es otra historia). Una parte muy interesante de este concepto es que se encuentran similitudes y, por tanto, se pueden pueden aplicar las ecuaciones termodinámicas, entre una disolución en la que el soluto está parcialmente ionizado con un gas parcialmente disociado. Siguiendo esta línea de razonamiento Wilhelm Ostwald llegó a su “ley de la dilución” en 1887, posteriormente confirmada experimentalmente, en la que afirma que existe una relación constante entre el grado de disociación (α) de una molécula y el volumen de la disolución (v) que contiene un mol del electrolito, en concreto
α2/(1- α)v = k
donde k , como se demostraría más tarde, es la constante de equilibrio. Esta relación proporciona un modo de medir la fortaleza de ácidos y bases. Veámoslo.
Consideremos el agua, que se disocia como:
2H2O ↔ H3O+ + OH–
Como a partir de medidas de conductividad sabemos que α para el agua es del orden de 10-8, la ley de Ostwald podemos aproximarla a
k = α2/v, ya que (1- α) es prácticamente 1.
Por otro lado, la constante de equilibrio de la disociación, es decir,
k = [H3O+][OH–]/[H2O]
donde los corchetes indican concentración de la especie moles por litro (o dm3), se puede reducir a
k’ = [H3O+][OH–]
Lo que es cierto porque la cantidad de agua es muy grande y, por tanto, [H2O], prácticamente constante.
Este producto, llamado producto iónico del agua, es constante a ciertas temperaturas en las que, en la práctica, toma un valor de 10-14 mol2/dm6. Esto es lo mismo que afirmar que para el agua pura a determinadas temperaturas
[H3O+] = [OH–] = 10-7 mol/dm3.
Si bien varios investigadores ya habían sugerido que la concentración de ion hidronio (H3O+) podía usarse como una referencia para comparar la fortaleza de los ácidos y bases, no fue hasta 1909 que el bioquímico sueco Søren Peder Lauritz Sørensen sugirió eliminar el uso de un número exponencial, con exponente negativo además, y sustituirlo por el logaritmo en base 10 cambiado de signo de [H3O+] , formando de esta forma una escala que iba convenientemente de 1 a 14, con el 7 para “neutro”. Como Sørensen, que se expresaba en alemán, abrevió la “potencia de la concentración de ion hidronio” a potenz-H, o pH, esto es,
pH = -log10[H3O+]
La escala de pH tuvo una aceptación inmediata entre la comunidad biológica/bioquímica. Los químicos no empezaron a usarla hasta unos años después, con la aparición del libro de 1914 de Leonor Michaelis sobre las concentraciones de ion hidronio. La emigración de Michaelis a Estados Unidos en 1926, propagó la escala a aquel país, y la aparición del pehachímetro portátil de Arnold Beckam en 1935 terminó de convertir a los indecisos.
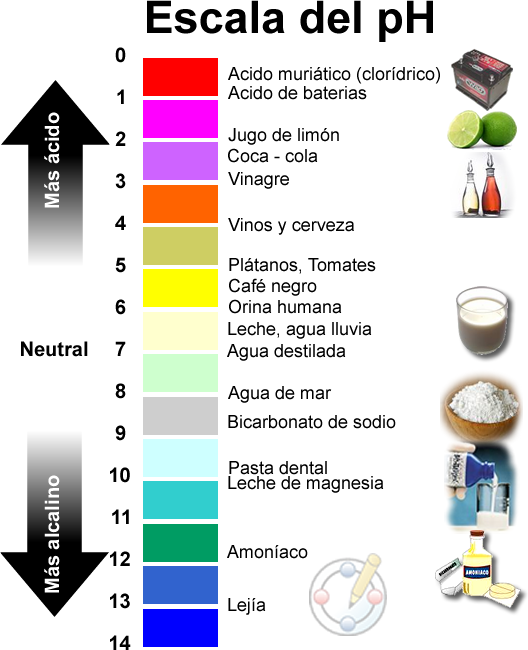
Una definición conveniente para sistemas biológicos (terráqueos)
Hoy día esta definición de pH es la que aparece en la mayoría de libros de texto de química general, y es la que la inmensa mayoría de personas asume. Pero démonos cuenta de que se hacen muchas suposiciones en esta definición, entre otras que las especies no interaccionan entre sí, esto es, que el ácido o la base se disocian en agua y esta disociación no se ve afectada por otras especies presentes. Además que los efectos de la temperatura son despreciables y que la cantidad de agua es mucho mayor que las especies disueltas en ella.
Si nos fijamos esas suposiciones encajan bastante bien con los sistemas biológicos que conocemos y el rango de la escala definida se adapta convenientemente. A título de ejemplo señalemos que el pH más bajo que tiene nuestro cuerpo se mide en el estómago, corresponde al ácido gástrico y vale 1; nuestra piel tiene un pH de 5,5, la sangre del orden de 7,4 (como comparación el agua a 37ºC tiene 6,8; 7 solamente en condiciones normalizadas) y las secreciones del páncreas, que son las más básicas, 8,1.
El problema surge cuando se tratan sistemas químicos alejados de las condiciones idealizadas de esta definición de pH o cuando tratamos sistemas biológicos en condiciones extremas: alta salinidad, temperaturas muy bajas o muy altas, cantidades mínimas de agua líquida presente, etc. De hecho, el artículo al que nos referíamos al comienzo trata de la búsqueda de vida extremófila en un entorno en el que el pH es de -3,6 (menos tres coma seis). Un simple cálculo nos indica que, con la definición de pH que tenemos, la concentración de ion hidronio es de ¡3981 moles por litro de disolución! ¡No tiene sentido!. ¿Se han equivocado los autores? No, es que la definición de pH que hemos visto no es válida en términos estrictos para ningún sistema real. Como el concepto nuevo que necesitamos puede ser un poco complicado de entender al principio, vámonos al fútbol primero.
Bienvenidos al Estadio Olímpico de Páramos de Hiendelaencina
Consideremos [esto a los españoles les costará menos] que en Páramos de Hiendelaencina, que tiene 1000 habitantes pero está cerca de una parada de tren de alta velocidad y también está próximo al nuevo aeropuerto intercontinental, hace unos pocos años se construyó un estadio olímpico con capacidad para 150.000 personas, todas sentadas. Mientras llegan o no las olimpiadas y aviones al aeropuerto, el estadio lo usa el equipo de fútbol del pueblo que, gracias al patrocinio del constructor local y presidente, milita en la segunda división B.
Un aficionado al fútbol de Páramos, con algún conocimiento de matemáticas y química, decide crear una escala de popularidad/fortaleza de los equipos de fútbol que visitan el estadio en función del número de espectadores que acuden a verlo. Su fórmula es muy sencilla: es el logaritmo cambiado de signo del número resultante de dividir los espectadores que acuden a un partido por el número de asientos que tiene el estadio. Ha llamado a su escala PdH, y en ella cuanto más bajo es el número más fuerte es el equipo visitante.
Estos son algunos resultados obtenidos, incluyendo partidos de la Copa del Rey:
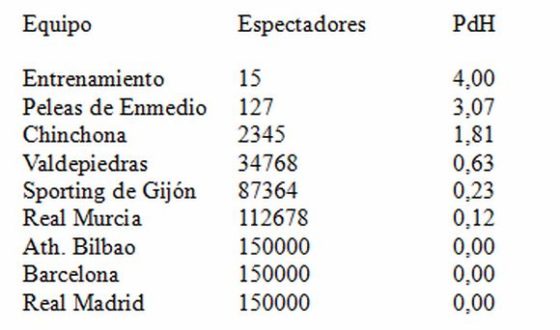
Observando la tabla vemos las limitaciones de la escala en aquel año histórico en el que el Páramos jugó la final de la Copa del Rey. La escala otorga la misma fuerza a un Atleti que a un Barcelona o un Real Madrid y, aunque en justicia ello es así, la realidad es que la capacidad de atracción de los dos últimos equipos es mucho mayor.
¿Cómo tendríamos que reformar la escala para que siguiese siendo válida? Tendríamos que tener en cuenta la misma unidad de medida básica, espectadores, aunque existen otras posibilidades además de los que van al estadio como los espectadores por televisión, u otras variables más rebuscadas como el precio de la reventa. A efectos de nuestra exposición vamos a considerar además de los espectadores en el estadio solo a los espectadores presentes en Páramos, esto es, a los que acuden a las pantallas habilitadas en la era del tío Eufrasio, antiguo Campo Municipal de fútbol. Fijémonos que, al incluir a estos espectadores, la PdH se hace negativa.
Sin embargo, el creador de la escala, queriendo prepararla para el futuro, se da cuenta de que su definición no sirve para captar la fortaleza de un equipo si no considera otros factores además de los espectadores del estadio y de las pantallas. Entre ellos están el tiempo meteorológico, el morbo del partido (como el clásico con el Valdepiedras) y la competición que se juega. Así que crea una nueva variable a la que llama actividad y que incluye de alguna forma todo lo anterior y define la nueva escala PdH+ en función del logaritmo cambiado de signo de esa actividad.
Una escala de pH para el mundo real
En una disolución real nos ocurre exactamente igual. Tenemos que tener en cuenta la temperatura de la disolución y el entorno en el que se van a encontrar los iones. De la misma forma que no es lo mismo un amistoso para recaudar fondos para el asilo con el Valdepiedras que el partido decisivo de la liguilla de ascenso con el mismo equipo, o ir a ver el partido con tu abuelo que con los setenta de la peña, la acidez de una sustancia depende de qué otras cosas haya en juego en la disolución.
Al igual que nuestro amigo de Páramos, también se define una actividad química en términos de lo una variable termodinámica que se llama potencial químico, que tiene en cuenta todos los factores que hemos mencionado y algunos más. Pero, ¿tanto afecta el entorno realmente? Veamos un ejemplo. El cloruro magnésico es una sal que se disuelve bien en agua. En un mundo ideal el pH de una disolución de un ácido no debería verse afectado por la presencia de cloruro magnésico. Sin embargo, esto no es así. Cuando una disolución muy ácida (pH = 1) que contiene el indicador verde de metilo se añade [él (ácido) sobre ella (agua), siempre] a una disolución 5 M de cloruro de magnesio, el color del indicador vira de verde a amarillo, señalando que la acidez ¡ha aumentado!
Es por ello que las constantes de equilibrio se definen en términos de actividad, no de concentraciones, aunque se usen éstas como aproximaciones. Como las constantes de equilibrio están en la base de la definición de pH, éste se define como el logaritmo cambiado de signo de la actividad del ion hidronio.
Con esto en mente ya sabemos que si vamos a estudiar, por ejemplo, la vida en sitios como el río Tinto, que el pH medido variará significativamente de un día de invierno a bajo cero a uno de verano a 40 ºC a la sombra; que variará además si el agua está muy turbia o cristalina (la has podido enturbiar tú al coger la muestra) y que variará por el lugar donde tomes la muestra, no sólo por la posible dilución sino por el aporte iónico del suelo por el que haya pasado.
Por tanto, a la hora de interpretar un dato de pH debemos tener en cuenta la temperatura a la que se midió y la composición exacta de la muestra. Pero esto sólo cuando necesitamos un poquito de precisión; para la piscina puedes seguir usando papelitos de colores.
Sobre el autor: César Tomé López es divulgador científico y editor de Mapping Ignorance
Una versión anterior de este texto se publicó en Naukas el 9 de mayo de 2012.

Alfredo
«Acido clorídrico»
¡¡mis hogos!!