El cerebro se compone de células, unidades de vida que hacen posible la función; la matriz extracelular, el andamio alrededor del cual las células se organizan; y los vasos sanguíneos, las autopistas encargadas de transportar combustibles celulares como el oxígeno y los nutrientes. Dentro del cerebro, podemos distinguir dos tipos principales de poblaciones celulares. Las neuronas, células especializadas en la transmisión de la información; y las células gliales, que incluyen los astrocitos, los oligodendrocitos, y la microglía, y se encargan de realizar funciones esenciales que favorecen y optimizan la transmisión de información por las neuronas.
La microglía es el tipo celular que defiende y protege el cerebro frente a las lesiones. Constituyendo alrededor del 10% de las células cerebrales, la microglía se distingue por poseer un cuerpo pequeño y estático, rodeado de ramificaciones finas y largas que se mueven sin cesar, registrando el ambiente. Para ello, contienen una diversidad de moléculas que detectan, procesan y responden a cambios químicos y/o físicos que ocurren en el ambiente microglial próximo. Tras la activación de estas moléculas, la microglía pone en marcha acciones específicas que favorecen la recuperación del balance tisular. Así, la microglía limpia los residuos tóxicos originados por la función cerebral en un proceso denominado fagocitosis, esencial para el buen funcionamiento del cerebro. Por tanto, es una prioridad promover la función y la salud de la microglía tras una lesión cerebral, como por ejemplo la inducida por el infarto cerebral.
El infarto cerebral de tipo isquémico se produce por la formación de un tapón vascular en una arteria cerebral, produciéndose la interrupción del flujo sanguíneo a las áreas cerebrales irrigadas por dicha arteria. La duración y la intensidad del bloqueo vascular determinan la magnitud de privación de oxígeno y nutrientes que sufren las neuronas y las células gliales del tejido circundante al vaso sanguíneo afectado, pudiendo llegar a producir muerte neuronal. Las neuronas son células con una alta especialización funcional y baja resistencia al estrés, siendo normalmente el primer tipo celular en morir en cantidades significativas. Las células gliales, y más en concreto la microglía, también sufre durante la privación de oxígeno y nutrientes que ocurre durante el infarto cerebral.
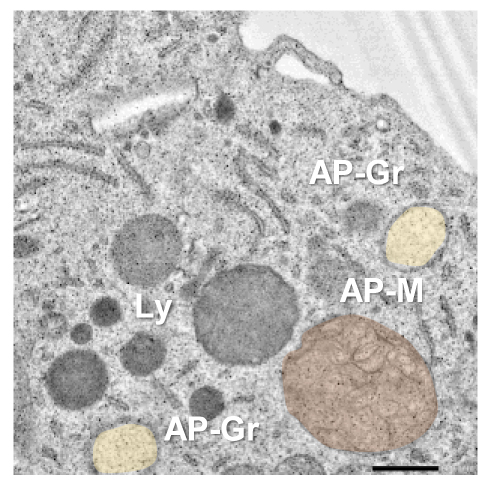
En un artículo de investigación reciente1, hemos demostrado que la microglía pierde su habilidad para fagocitar los restos de neuronas muertas tras el infarto cerebral en modelos de ratón y mono. La fagocitosis y eliminación de los residuos neuronales por parte de la microglía es esencial para el mantenimiento de un ambiente cerebral saludable. De hecho, la microglía reconoce, engloba y digiere los despojos de las neuronas muertas de forma muy eficiente en el cerebro sano, no dejando rastro alguno del paso de esas neuronas por el cerebro. Sin embargo, cuando existe un fallo en la limpieza de los cadáveres neuronales por la microglía, las neuronas muertas pierden su integridad física y empiezan a liberar sustancias tóxicas, lo que afecta al bienestar de las células que se encuentran a su alrededor2. La degradación de los cuerpos neuronales fagocitados se lleva a cabo en los lisosomas, los principales orgánulos o compartimentos celulares dedicados a la digestión de moléculas biológicas en células de mamíferos como la microglía. Según nuestra investigación, durante el infarto cerebral, el bloqueo de la fagocitosis ocurre por una reducción de la disponibilidad de los lisosomas en microglía.
Los lisosomas son orgánulos redondeados y sellados con membrana de tamaño pequeño o medio. En su interior, disponen de toda la maquinaria necesaria para degradar cualquier tipo de macromolécula biológica como los carbohidratos, los lípidos, las proteínas y los ácidos nucleicos. Por lo tanto, los lisosomas no solo son capaces de degradar las macromoléculas que vienen desde el exterior celular (por ejemplo, las neuronas muertas internalizadas por la microglía mediante fagocitosis) sino que también tienen la capacidad de digerir contenido intracelular dañado o superfluo. Este último proceso se conoce como autofagia (comerse a uno mismo), y es una respuesta celular que se pone en marcha frente a estrés de tipo metabólico como la falta de oxígeno y nutrientes y promueve la supervivencia celular. En nuestro estudio, hemos observado que durante el infarto cerebral y ante la falta de oxígeno y nutrientes, se intensifica la respuesta autofágica en microglía1, posiblemente con el fin de eliminar las proteínas y los orgánulos tóxicos dañados para adaptarse a las nuevas condiciones metabólicas y finalmente promover la supervivencia de la microglía. Sin embargo, la promoción de la respuesta autofágica durante el infarto cerebral supone un coste para la microglía. De hecho, el incremento del reclutamiento lisosomal con fines autofágicos produce una disminución de la disponibilidad de los lisosomas para otros procesos digestivos, como por ejemplo, la fagocitosis de restos neuronales.
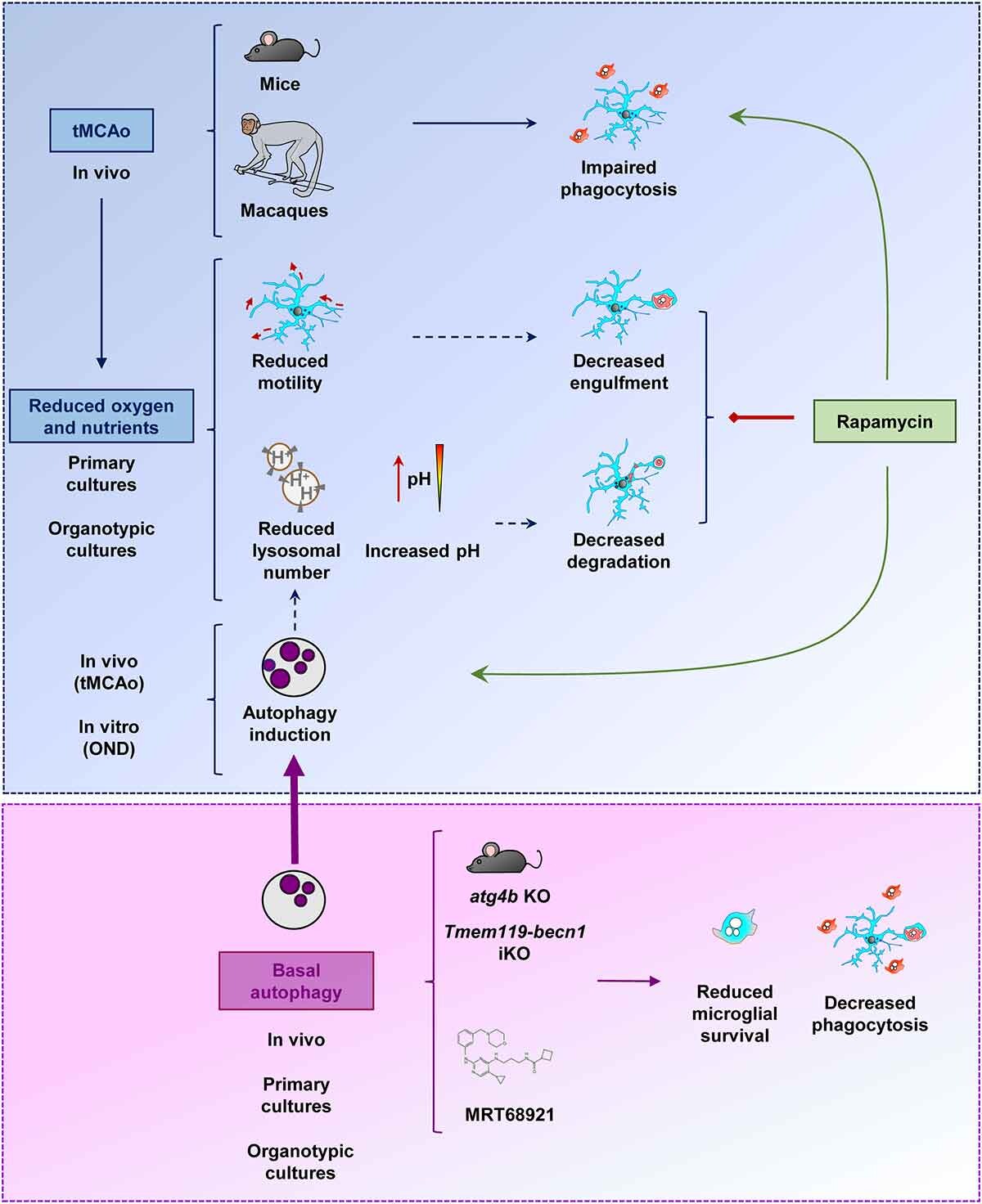
El bloqueo de la fagocitosis microglial en el infarto cerebral produce una acumulación de material tóxico en el cerebro, proceso que empeora la evolución de la enfermedad2. Por lo tanto, las estrategias dedicadas a la recuperación de la actividad fagocítica microglíal podrían suponer un beneficio terapéutico. Según nuestros resultados, cabría esperar que la inhibición de la autofagia liberara un número significativo de lisosomas, aumentando su disponibilidad y promoviendo de forma indirecta la digestión fagocítica microglial. Sin embargo, la inhibición de la autofagia es perjudicial para el estado físico y supervivencia de la microglía1. La estrategia alternativa de estimulación de autofagia mediante administración de rapamicina (un fármaco clásico inductor de autofagia) produce efectos complejos en microglía, que culminan en efectos beneficiosos, neutros, o tóxicos en función del modelo experimental usado para determinar la actividad fagocítica y la supervivencia microglial1. Aunque la modulación de la autofagia resultó ser inefectiva o no concluyente para la modulación de la fagocitosis microglial en este estudio, los datos obtenidos fueron cruciales para entender la complejidad mecanística de las respuestas lisosomales en microglía durante el infarto cerebral y contribuirán al desarrollo de nuevas estrategias terapéuticas enfocadas a aumentar la respuesta protectora microglial durante el infarto cerebral.
Referencias
1Beccari S, Sierra-Torre V, Valero J, Pereira-Iglesias M, García-Zaballa M, Soria FN, De las Heras-García L, Carretero-Guillén A, Capetillo-Zarate E, Domercq M, Huguet PR, Ramonet D, Osman A, Han W, Dominguez C, Faust TE, Touzani O, Pampliega O, Boya P, Schafer D, Mariño G, Canet-Soulas E, Blomgren K, Plaza-Zabala A, Sierra A (2023) Microglial phagocytosis dysfunction in stroke is driven by energy depletion and induction of autophagy. Autophagy 20: 1-30. doi: 10.1080/15548627.2023.2165313
2Abiega O, Beccari S, Díaz-Aparicio I, Nadjar A, Layé S, Leyrolle Q, Gómez-Nicola D, Domercq M, Pérez-Samartín A, Sánchez-Zafra V, Paris I, Valero J, Savage JC, Hui CW, Tremblay ME, Deudero JJ, Brewster AL, Anderson AE, Zaldumbide L, Galbarriatu L, Marinas A, Vivanco Md, Matute C, Maletic-Savatic M, Encinas JM, Sierra A (2016) Neuronal hyperactivity disturbs ATP microgradients, impairs microglial motility, and reduces phagocytic receptor expression triggering apoptosis/microglial phagocytosis uncoupling. PLoS Biol 14:e1002466. doi: 10.1371/journal.pbio.1002466
La versión original de este artículo apareció en inglés en Mapping Ignorance. Traducción de las autoras.
Para saber más:
La hiperactividad neuronal impide que las microglías realicen su trabajo
La microglía es un sensor de mortalidad neuronal
Más allá de las neuronas
Sobre las autoras: Ainhoa Plaza-Zabala1, 2 y Amanda Sierra1,3,4
1 Laboratorio de Biología Celular Glial, Achucarro Basque Center for Neuroscience
2 Dpt. de Farmacología, Universidad del País Vasco (UPV/EHU)
3 Dpt. de Bioquímica y Biología Molecular, Universidad del País Vasco (UPV/EHU)
4 Fundación Ikerbasque
Renovarse o morir: cuando se atasca el sistema de reciclaje cerebral — Cuaderno de Cultura Científica
[…] renovación es posible debido al envío de estructuras macromoleculares al lisosoma –la “trituradora celular”– mediante un proceso denominado autofagia, palabra que significa […]