La dieta del padre influye en la salud metabólica del hijo

Los genes del espermatozoide contribuyen de forma decisiva al individuo que se formará tras la fecundación del óvulo. En el caso de los humanos, los 23 cromosomas paternos se combinan con el mismo número de cromosomas maternos para originar un nuevo ser. ¿Existe alguna contribución paterna al margen de la cromosómica? Se suele afirmar que las mitocondrias, que también contienen su propio conjunto de genes, no se transmiten por vía paterna, y que la herencia mitocondrial es exclusivamente materna. Esto es algo inexacto, ya que sí hay mitocondrias del espermatozoide que acceden al óvulo, pero tanto ellas como su ADN terminan siendo eliminados por diversos mecanismos.
Desde hace relativamente poco tiempo sabemos que hay otra aportación del espermatozoide cuya importancia empezamos a conocer. Se trata de las moléculas conocidas como sncRNAs (por small non-coding RNA, pequeñas secuencias de ácido ribonucleico no codificante). Tienen una longitud inferior a los 200 nucleótidos y derivan de fragmentos de ARN de transferencia y ribosómico. Estos ARN se encargan, respectivamente, del transporte de aminoácidos para ensamblar el polipéptido y de organizar el ribosoma en el que se produce dicho ensamblaje.
El conjunto de sncRNAs que el espermatozoide entrega al óvulo junto con su núcleo es complejo, dinámico y sensible a influencias ambientales. También sabemos que influye tanto en el desarrollo embrionario como en las características del adulto (su fenotipo). Aquí pueden encontrar una reciente revisión sobre el tema. Esta influencia de los sncRNAs sobre el fenotipo adulto se produce a nivel epigenético, es decir, sin implicar cambios en la secuencia del ADN. Los sncRNAs transferidos desde el espermatozoide pueden modular la expresión de los genes del descendiente provocando cambios fenotípicos. Hablamos por tanto de una herencia epigenética influida por factores ambientales.
Un artículo recién publicado en Nature por un grupo de investigadores alemanes y austríacos ha mostrado que, en ratones, la dieta del padre en el momento del apareamiento tiene influencia en la salud metabólica de los descendientes masculinos, y que esta influencia se produce a nivel epigenético mediante la aportación espermática de sncRNAs.
Un primer experimento consistió en alimentar a ratones macho con una dieta rica en grasa durante dos semanas. Estos ratones se aparearon con hembras y se comprobó que alrededor del 30% de los descendientes masculinos desarrollaban resistencia a la insulina e intolerancia a la glucosa, signos característicos de la diabetes de tipo II. En un segundo ensayo, tras las dos semanas de dieta grasa, los ratones volvieron a recibir una dieta normal durante un mes. Tras el apareamiento, los descendientes no desarrollaron ningún problema metabólico. Los investigadores concluyeron que la influencia de la dieta se ejercía durante el periodo de maduración de los espermatozoides en el epidídimo. Vamos a explicar esto más despacio.
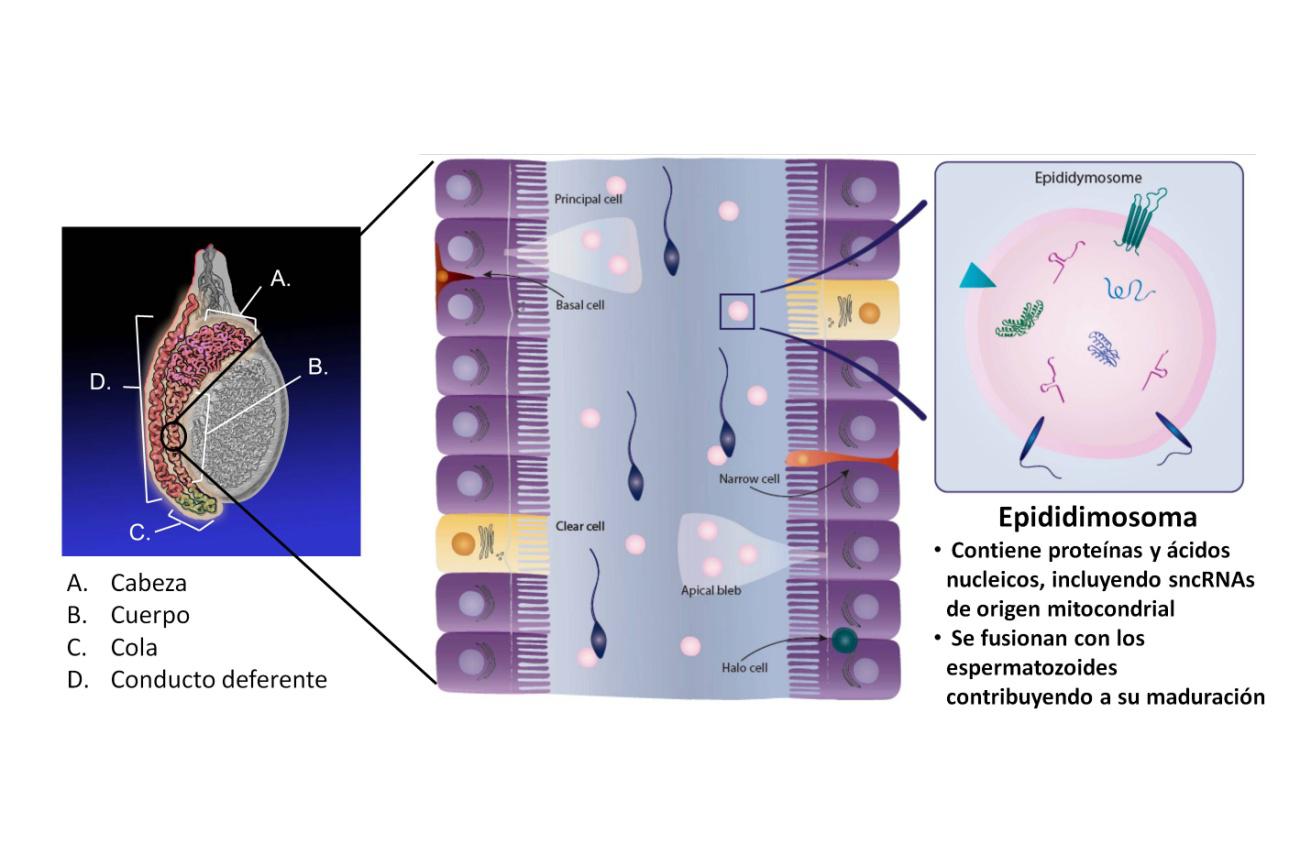
Los espermatozoides se forman en el testículo a partir de las células germinales, unos precursores con gran capacidad proliferativa. Una vez formados, atraviesan una larga estructura tubular llamada epidídimo1. Los espermatozoides del ratón emplean alrededor de una semana en recorrer este tubo de un metro de longitud. Durante el recorrido los espermatozoides incorporan epididimosomas, vesículas cargadas de moléculas procedentes del epitelio del epidídimo, entre ellas los sncRNAs que luego transferirán al óvulo (Figura 1).
El estudio de Nature mostró que si la dieta grasa se suspendía antes del ingreso de los espermatozoides en el epidídimo, no se producían consecuencias en la descendencia. Es decir, la (mala) influencia de la dieta grasa se producía durante el paso por el epidídimo. Y los responsables de esto eran los sncRNAs transferidos. De hecho, la dieta grasa provocaba un aumento precisamente en los niveles de sncRNA de origen mitocondrial en todos los tejidos, epidídimo incluido, un cambio que revertía tras el regreso a la dieta normal.
De forma independiente, los investigadores estudiaron las consecuencias de las mutaciones en dos genes, Mrpl23 y Ndufb8, que causaban aumento de los fragmentos no codificantes de ARN mitocondrial. Los descendientes de los portadores masculinos de estas mutaciones mostraban las mismas alteraciones metabólicas que los descendientes de machos alimentados con dieta grasa.
Los autores de esta investigación indagaron si los resultados obtenidos en ratones podrían tener alguna implicación clínica. Comprobaron que los niveles de fragmentos de ARN de transferencia y de origen mitocondrial estaban correlacionados con el índice de masa corporal de los varones. Al mismo tiempo mostraron que el sobrepeso paterno en el momento de la concepción duplica el riesgo de obesidad de los hijos y compromete su salud metabólica. La carga de sncRNAs en el esperma podría ser el nexo entre estas dos observaciones.
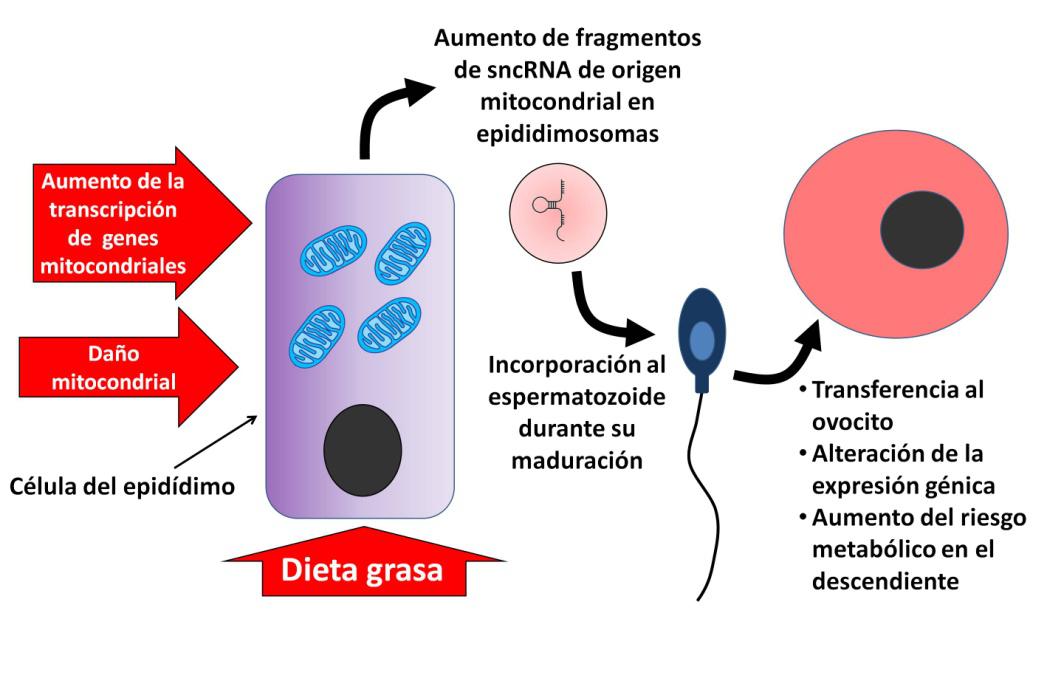
Un escenario apuntado en el artículo de Nature propone que la exposición a una dieta rica en grasas perjudicaría la función mitocondrial y que esto se intentaría compensar con una mayor transcripción de los genes mitocondriales (Figura 2). El consecuente aumento del contenido celular en ARN produciría un exceso de fragmentos de sncRNAs que, transportados por los espermatozoides, acabarían en el ovocito. Lo que todavía no sabemos es cómo estos fragmentos modulan la expresión de los genes embrionarios, cómo esta modulación epigenética acaba provocando consecuencias en el metabolismo de los descendientes, y por qué los hijos tienen más riesgo metabólico que las hijas.
En resumen, si es aconsejable siempre seguir una dieta saludable y mantener el peso corporal en niveles adecuados, podría serlo de forma especial para los hombres en el momento de la concepción.
Referencias:
Cai, C., Chen, Q. (2024) Father’s diet influences son’s metabolic health through sperm RNA. Nature. doi: 10.1038/d41586-024-01502-w
Tomar, A., Gómez-Velázquez, M., Gerlini, R. et al. (2024) Epigenetic inheritance of diet-induced and sperm-borne mitochondrial RNAs. Nature. doi: 10.1038/s41586-024-07472-3
Sobre el autor: Ramón Muñoz-Chápuli Oriol es Catedrático de Biología Animal (jubilado) de la Universidad de Málaga
Nota:
1 Como curiosidad el epidídimo humano, situado sobre el testículo, mide unos 4-5 centímetros, pero si se desenrollase alcanzaría los seis metros de longitud.
