Edición genética hereditaria: lo que era imprudente en 2018 lo sigue siendo en 2025
«Hace tan solo unas semanas, dos pequeñas y preciosas niñas chinas, llamadas Lulu y Nana, llegaron al mundo llorando tan sanas como cualquier otro bebé. Las niñas están ya en casa, con su madre Grace y su padre Mark».
Así comenzaba el video del informático He Jiankui en el que anunciaba la primera edición genética en embriones humanos de la historia. Su intención era que los bebés no expresaran una proteína, codificada por el gen CCR5, que el virus de inmunodeficiencia humana (VIH) utiliza como receptor para infectar las células. Era noviembre de 2018 y la comunidad científica se echó las manos a la cabeza ante uno de los experimentos más imprudentes que se han realizado jamás. El trabajo se llevó en secreto, sin relación alguna con la Universidad en la que desde hace meses ya no trabajaba y se comunicaba a través de un simple anuncio en Youtube. No había sido revisado por pares, no se había publicado en ninguna revista científica y, por supuesto, no había pasado ningún control bioético durante ninguna fase del proceso.
«Ni siquiera era médico, ni genetista, ni biomédico, ni nada parecido, era un informático especializado en física», explica Lluis Montoliu, divulgador, biólogo e investigador del CSIC en el Centro Nacional de Biotecnología. «He Jiankui estaba convencido de que iba a aportar un gran avance a la humanidad y con este mesianismo realizó una serie de fechorías. Manipuló los permisos del comité de ética del hospital, reunió a varias parejas, en las que el padre estaba infectado con el VIH, y las convenció de que la única manera para tener hijos libres del virus era mediante el protocolo que él les proponía, ocultándoles que ya existe un procedimiento establecido desde hace muchos años por el que se consiguen espermatozoides sin el virus que se usan luego en fecundación in vitro. En definitiva, les engañó, les ocultó la realidad científica y les empujó a un procedimiento completamente experimental de manera imprudente e improcedente».
Con el paso de las semanas se descubrieron irregularidades aún más graves en el trabajo de He Jiankui. «Hoy sabemos que hizo una biopsia de cada embrión, un análisis genómico en el que constató que el experimento le había salido mal, no solo era consciente de que el gen que quería inactivar seguía activo sino que además había inactivado genes que no tendría que haber tocado», cuenta Montoliu. «En ese momento Jiankui debería haber parado el experimento pero le pudo más el protagonismo de convertirse en una leyenda, y tal vez ganar un Premio Nobel, que embaucó a los ginecólogos del hospital dándoles a entender que se trataba de un procedimiento de fecundación in vitro normal».
Los desmanes de He Jiankui no acaban aquí. Además de las gemelas Lulu y Nana, hubo otra pareja engañada que dio a luz un tercer bebé modificado genéticamente, una niña llamada Aurea. La reacción gubernamental llegó a continuación y las autoridades chinas lo detuvieron, lo juzgaron y fue condenado a una multa de tres millones de yuanes y tres años de cárcel. Curiosamente esta condena no fue por realizar el experimento ya que, en aquel momento, China no contaba con una regulación en contra (ahora sí la tiene) sino por haber falsificado la revisión ética de su trabajo para atraer así a las parejas voluntarias, por haberse saltado el requisito del consentimiento informado y por usurpar profesionalmente una carrera que no tenía, ya que se presentaba ante esas parejas como médico.
Desde entonces no sabemos absolutamente nada de esos tres bebés. Ahora deberían tener siete años pero es como si hubieran desaparecido. «Yo he preguntado a varios colegas chinos en algunos congresos y ninguno tiene noticias. Lo más probable es que estas niñas tendrán que ser supervisadas médicamente el resto de su vida porque el hecho de que tengan alteraciones genéticas descontroladas pueden suponer un fallo orgánico o sistémico en cualquier momento, por lo tanto se les trasladó un riesgo muy alto y totalmente innecesario», asegura Montoliu.
A los pocos meses, la propia Organización Mundial de la Salud (OMS) anunció la creación de un registro global para rastrear las investigaciones en edición genética humana, enfatizando que «los países no deben permitir ningún trabajo adicional sobre la edición del genoma de la línea germinal humana hasta que se hayan considerado adecuadamente las implicaciones técnicas y éticas» y adelantó la creación de instrumentos de gobernanza eficaces para disuadir y prevenir usos irresponsables e inaceptables de embriones editados genéticamente para iniciar embarazos humanos.

Así llegamos hasta nuestros días en enero de 2025, un año que ha comenzado con un artículo escandaloso publicado por la propia Nature. El autor principal es el australiano Julian Savulescu, filósofo y bioeticista de la Universidad de Oxford, donde no solo presenta la posibilidad de editar un solo gen (como hizo He Jiankui) sino que abre la puerta a la edición de muchos genes a la vez para conseguir las variantes más adecuadas que eviten la enfermedad, que ofrezcan más salud o más longevidad. Sus conclusiones las extrae de un desarrollo matemático con el que está convencido de que «la edición poligénica hereditaria para proteger a las generaciones futuras de enfermedades, sin requerir intervenciones adicionales para cada generación, puede verse como una ventaja que la convierte en una opción más deseable que la edición somática».
A grandes rasgos, la edición genética se divide en dos grandes clases: la edición genética somática, también conocida como edición terapéutica, que tan solo implica cambios realizados en una persona que no son hereditarios y no van a ser transmitidos a la descendencia, y la edición genética hereditaria, de línea germinal o de embriones, que supone modificar el genoma heredable y que se transmitirá a generaciones futuras. De esta manera, el artículo de Savulescu especula directamente con la posibilidad de editar el genoma en embriones humanos, no solo en una posición, sino en múltiples localizaciones, escogiendo para cada gen determinadas variantes genéticas asociadas a características aparentemente beneficiosas, protectoras frente a enfermedades, con el objeto de mejorar los seres humanos, no para curarlos.
«Esto es, simple y llanamente, eugenesia», afirma Montoliu. «Es un ejercicio teórico matemático que falla por todos lados y da a entender que la edición genómica con las herramientas CRISPR es mucho más segura, certera y reproducible de lo que sabemos hoy en día que es, y de lo que probablemente va a ser durante mucho tiempo, para este tipo de modificaciones que requieren precisión y reproducibilidad. La mayoría de las estrategias terapéuticas actuales que usan las herramientas CRISPR no intentan corregir ni modificar genes, sino inactivarlos, destruirlos, algo muy diferente para lo que no se requiere tanta precisión».
Junto al artículo publicado por Savulescu, la revista Nature ofrece también un artículo crítico firmado por Kevin Mitchel, genetista del Trinity College de Dublin. En esta respuesta, Mitchel desmonta las especulaciones matemáticas de Savulescu y afirma que la edición en línea germinal es insegura, no tiene evidencias científicas y que implica un riesgo considerable y beneficios inciertos. De igual modo, la asociación científica ARRIGE (Asociación para la Investigación Responsable e Innovación en Edición Genética), desde la que se promueve un uso responsable de las técnicas de edición genética, también ha publicado un comunicado rechazando, por irresponsable e innecesaria, esta propuesta de edición genética múltiple del genoma humano.
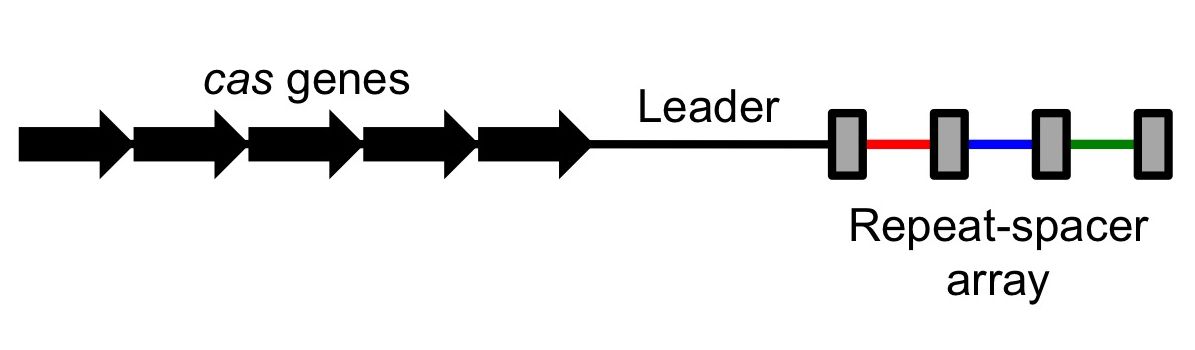
Hace aproximadamente once años, a principios de 2014, escribí un artículo en este mismo Cuaderno de Cultura Científica de la UPV/EHU, titulado «La inminente revolución de la ingeniería genética basada en el sistema CRISPR/cas» y, me di cuenta de que su avance sería imparable. Rápidamente empezaron a aparecer las primeras aplicaciones con las evidentes preocupaciones éticas asociadas. Las terapias de edición genética para curar enfermedades de base genética ya están al orden del día y se administran en todos los países, también aquí en España, pero otra cosa muy distinta son estos experimentos que, bajo la influencia de dudosas filosofías transhumanistas, utilizan tecnologías CRISPR con la intención de mejorar a un ser humano con genes que podría transmitir a su descendencia.
«Hace algo más de diez años, en la primera cumbre internacional sobre el tema hubo una serie de intervenciones que dejaban claro que el uso de las herramientas CRISPR para editar genes mutados en embriones, con la intención de que ese embrión nazca con una determinada enfermedad, no son necesarias», recuerda Montoliu. «Con la excepción de unos pocos casos, extremadamente raros y poco habituales, donde el padre y la madre sean portadores de mutaciones de tal manera que su descendencia posea el cien por cien de posibilidades de heredarlas, la inmensa mayoría de supuestos se solucionan con tecnologías ya disponibles. Contamos con diagnósticos genéticos preimplantacionales que nos permiten distinguir cuál es el embrión que lleva la mutación y cuál es el que no la lleva y seleccionar ese embrión para que se geste solamente el que no lleva la mutación».
En 2023 se aprobó en Reino Unido la primera terapia basada en CRISPR, un tratamiento denominado Casgevy que se aplica a personas mayores de 12 años afectadas por anemia falciforme con crisis recurrentes de oclusión vascular o por beta-talasemia dependiente de transfusiones, para las que no existan donantes de médula ósea compatibles. Esto es el futuro pero es muy diferente a lo que propone Sabulescu desde Nature. Las terapias CRISPR deben centrarse en «tratar a personas adultas y enfermas con terapias génicas somáticas», concluye Montoliu, «no para aquellos que quieran vivir cien años o que pretendan bonitos ojos azules para sus hijos».
Referencias y más información:
Julian Savulescu et al. (2025) Heritable Polygenic Editing: The next Frontier in Genomic Medicine? Nature (2025) DOI: 10.1038/s41586-024-08300-4.
Kevin Mitchel et al. (2025) Human Embryo Editing against Disease Is Unsafe and Unproven — despite Rosy Predictions Nature (2025) DOI: 10.1038/d41586-024-04105-7.
Comunicado de la Asociación para la Investigación Responsable e Innovación en Edición Genética (ARRIGE): ARRIGE statement on heritable polygenic editing
Agradecimientos a Lluis Montoliu, biólogo e investigador del CSIC en el Centro Nacional de Biotecnología.
Sobre el autor: Javier «Irreductible» Peláez (Puertollano, 1974) es escritor y comunicador científico. Autor de 500 años de frío. La gran aventura del Ártico (Crítica, 2019) y Planeta Océano (Crítica 2022). Es uno de los fundadores de la plataforma Naukas.com, editor de ciencia en Yahoo España y Latinoamérica. Es guionista científico en los programas de televisión «El Cazador de Cerebros» y «Órbita Laika» de RTVE. Durante más de una década ha escrito en diferentes medios de comunicación (El País, El Español, National Geographic, Voz Populi). Es autor de los podcasts Catástrofe Ultravioleta y La Aldea Irreductible, y ha colaborado en diferentes proyectos radiofónicos y televisivos (Radio Nacional de España, Radio Televisión Canaria). Es ganador de tres premios Bitácoras, un premio Prisma a la mejor web de divulgación científica y un Premio Ondas al mejor programa de radio digital.
Adam
He Jankui se doctoró en biofísica. No es un ajeno a la biología como lo venden acá. Son periodistas. Infórmense e informen bien. Después discutimos sobre el bien y el mal.
César Tomé
La cualificaciones de He aparecen en una cita de las declaraciones de un profesor de investigación en genética adecuadamente entrecomilladas. Desde el punto de vista periodístico queda clara que la responsabilidad es de quien enuncia la frase.
No obstante lo anterior, He estudió física y se doctoró en biofísica, lo que implica que estaba familiarizado por formación con los protocolos éticos de investigación en física, no en biología. Las técnicas de manipulación genética las aprendió como postdoc. No se afirma que fuese ajeno a la biología, como usted torticeramente afirma, obviamente no podía hacer lo que hizo sin conocimientos técnicos de manipulación genética, sino que su pasado formativo no le proporcionaba los estándares éticos que aporta la investigación básica en biología/medicina. Estándares que no dudó en violar dolosamente para conseguir sus fines.
Donde las dan las toman: asegúrese de que ha comprendido lo que lee antes de realizar según qué comentarios.
Masgüel
Parece haber pasado desapercibido que Kevin Mitchell, autor del artículo crítico en Nature, es el mismo de «Free agents», de la polémica con Sapolkski el año pasado sobre el libre albedrío. Está en todos los fregaos y siempre del lado sensato.