Células tumorales aumentan su agresividad robando mitocondrias a células nerviosas
Nuestros órganos están inervados por el sistema nervioso. Podría pensarse que un tumor, resultado de un crecimiento celular anárquico, debería carecer de nervios, pero no es así. Frecuentemente los tumores adquieren inervación, bien por captación de fibras nerviosas periféricas o por diferenciación de progenitores neurales que son reclutados por el tumor.
Desde hace algún tiempo se venía sospechando que la inervación favorece la progresión tumoral. Por citar un ejemplo, en 2017 se demostró que la eliminación de los nervios asociados al cáncer de próstata, bien de forma quirúrgica o anulando su función con toxina botulínica, reducía el crecimiento del tumor. Por otro lado, se ha establecido una relación entre la densidad de fibras nerviosas de algunos cánceres y su capacidad metastásica. Lo que se ignoraba es qué ventaja obtenían las células tumorales de su proximidad a fibras nerviosas.
Se acaba de publicar en Nature un estudio de las universidades de Texas y de Alabama del Sur que parece haber dado con la clave del enigma. Las células tumorales obtienen mitocondrias de las fibras nerviosas con las que están en contacto. Recordemos que las mitocondrias son los orgánulos en los que se produce la mayor parte de la energía que necesitan las células. Esta energía se genera mediante la oxidación de carbohidratos y ácidos grasos.
Ya se había observado en 2023 la transferencia de mitocondrias neurales hacia glioblastomas (el tumor cerebral más agresivo), pero el nuevo estudio confirma el fenómeno en tumores externos al sistema nervioso central.
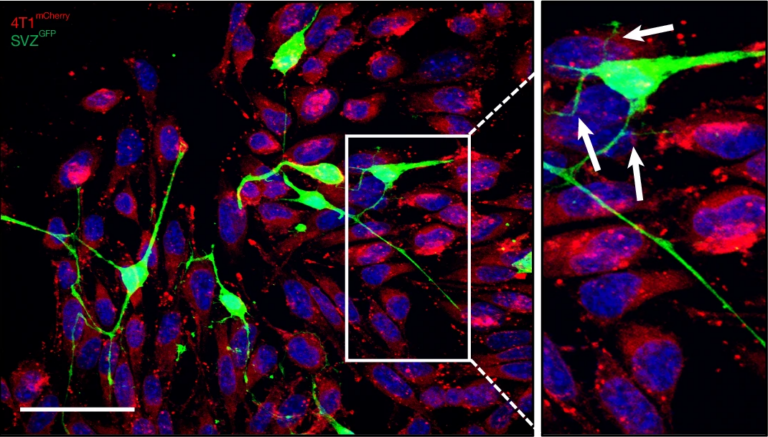
Para poner de manifiesto la transferencia, se utilizaron cultivos de neuronas cuyas mitocondrias estaban marcadas con un pigmento fluorescente verde y células 4T1 (un tipo de cáncer de mama especialmente agresivo) marcadas en rojo. Se observó que las neuronas incrementaban su masa mitocondrial cuando contactaban con las células tumorales. A continuación, se comprobó que las mitocondrias (marcadas en verde) se desplazaban de las neuronas a las células 4T1 a través de finos nanotubos (Figura 1). Lo mismo sucedía con otros tipos celulares, pero siempre las células nerviosas fueron los mejores donantes de mitocondrias.
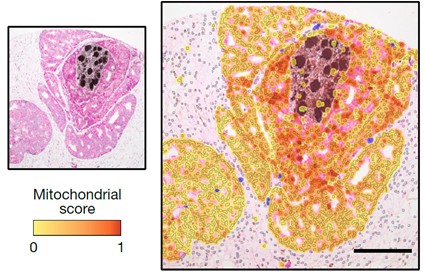
El estudio de secciones histológicas de tumores de próstata humanos confirmó que la carga mitocondrial del cáncer era mayor en las proximidades de los nervios (Figura 2).
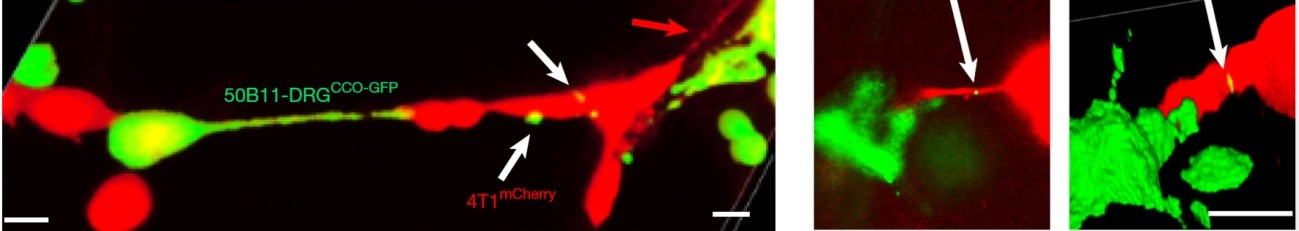
Otro experimento consistió en generar células tumorales con mitocondrias no funcionales. Aunque estas células pueden sobrevivir sin respiración mitocondrial, por el motivo que luego explicamos, su metabolismo es bajo y no proliferan bien. El cultivo de estas células con neuronas les permitió regenerar su población mitocondrial y recuperar su capacidad de proliferación.
La transferencia de mitocondrias neuronales a células tumorales también se producía si se inyectaban los dos tipos de células en la grasa abdominal de ratones. Eso sí, la inyección simultánea de toxina botulínica (neurotóxica) reducía la transferencia, el metabolismo tumoral y la capacidad para formar metástasis.
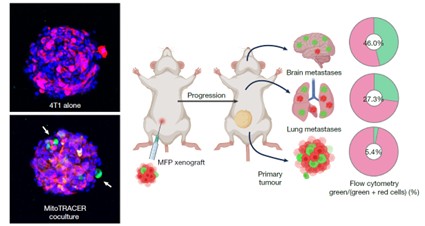
El resultado más relevante se obtuvo con un modelo experimental en el que las células tumorales marcadas en rojo pasaban a emitir una fluorescencia verde si recibían mitocondrias neuronales[1]. Se comprobó que en el tumor primario formado en la grasa abdominal sólo un 5% de las células tumorales habían recibido mitocondrias de origen neuronal. Sin embargo, en las metástasis pulmonares, ese porcentaje ascendía al 27%, y alcanzaba el 46% en las metástasis cerebrales, nueve veces más que en el tumor primario (Figura 3). Esto indicaba que las células del cáncer con mitocondrias “robadas” tenían una mayor tendencia a extenderse por el cuerpo del ratón generando metástasis.
Los resultados son sorprendentes y contraintuitivos por las características del metabolismo de las células tumorales. Estas no suelen obtener energía de la respiración mitocondrial, sino de un proceso llamado glucólisis, que no requiere oxígeno, lo que se conoce como efecto Warburg. Las células tumorales dilapidan grandes cantidades de glucosa para producir lactato y energía de una forma mucho menos eficiente que si la oxidaran en las mitocondrias. Entonces, ¿por qué supone una ventaja para el cáncer disponer de más mitocondrias?
Los autores del estudio proponen que el tumor enriquecido en mitocondrias adquiere una mayor plasticidad metabólica, y una capacidad incrementada para adaptarse a condiciones cambiantes durante la progresión tumoral y la metástasis. De ser así, este descubrimiento proporcionaría una nueva oportunidad terapéutica si se pudiera bloquear de alguna forma la transferencia mitocondrial.
Por otro lado, conocer mejor los mecanismos de transferencia mitocondrial podría tener un aspecto positivo. Diversas patologías relacionadas con el envejecimiento (enfermedades neurodegenerativas o cardiovasculares) están asociadas a un déficit o una disfunción mitocondrial. Recordemos que estos orgánulos son la factoría principal de generación de energía de nuestras células. Ya se están ensayando diversas estrategias de transferencia/transplante de mitocondrias en células sanas, como se describe en esta revisión. Por desgracia, las células cancerosas se nos han adelantado y han aprendido a hacer esto en su propio beneficio.
Referencias
Hoover, G., Gilbert, S., Curley, O. et al. (2025) Nerve-to-cancer transfer of mitochondria during cancer metastasis. Nature. doi: 10.1038/s41586-025-09176-8.
Nota:
[1] En este vídeo [descarga] se muestra cómo una célula tumoral en cultivo con fluorescencia roja (flecha azul) emite nanotubos para contactar con neuronas (flechas amarillas). Al adquirir mitocondrias neuronales su fluorescencia cambia a verde. De Hoover et al. (2025), cita completa en referencias, con licencia CC BY-NC-ND 4.0.
Sobre el autor: Ramón Muñoz-Chápuli Oriol es Catedrático de Biología Animal (jubilado) de la Universidad de Málaga.