La lactancia materna fue un factor esencial en el éxito evolutivo de los mamíferos. La posibilidad de alimentar al neonato extiende en el tiempo la inversión parental, es decir, el esfuerzo invertido por los progenitores para optimizar la supervivencia de su prole. Los mamíferos placentados alimentan a sus descendientes antes y después del parto, de forma que crezcan, maduren y puedan enfrentarse con mayores garantías a los desafíos que encontrarán antes de llegar a la edad reproductiva.
Las aves también han optado por una estrategia de alimentación postnatal, transportando comida al nido y distribuyéndola a los polluelos. Sin embargo, la lactancia de los mamíferos es excepcional. Las madres sintetizan el alimento necesario para sus crías en las glándulas mamarias. Estas glándulas se preparan para la producción de leche a lo largo de la gestación, bajo el control hormonal de estrógenos, progesterona y prolactina. Tras el parto, la secreción de leche (lactogénesis) es activada por la prolactina.
Esto es lo que sabíamos hasta ahora, pero un artículo que acaba de ser publicado en la revista Cell por un grupo de investigadores del NIH (Bethesda, EE.UU.) ha revelado otros protagonistas inesperados de la lactogénesis. Se trata de linfocitos, en concreto de un tipo no convencional de linfocitos T denominados mIEL (por mammary intraepithelial lymphocytes).
La función de los linfocitos y del resto de células del sistema inmune es protegernos contra las infecciones y los agentes externos en general. No obstante, en los últimos años estamos comprendiendo que, más allá de las tareas defensivas, células inmunitarias también participan en otras funciones relacionadas con el desarrollo y la vida adulta.
El grupo del NIH, liderado por Yasmine Belkaid, observó que una deficiencia en linfocitos perjudicaba el desarrollo de las mamas y la lactancia en ratones. En concreto, vieron que linfocitos no convencionales del tipo T-bet [1] se acumulaban en las mamas de los ratones durante la gestación. Su deficiencia, inducida mediante manipulación genética, provocaba un menor desarrollo de las glándulas mamarias, una menor producción de leche y, como era de esperar, una menor ganancia de peso por parte de las crías.
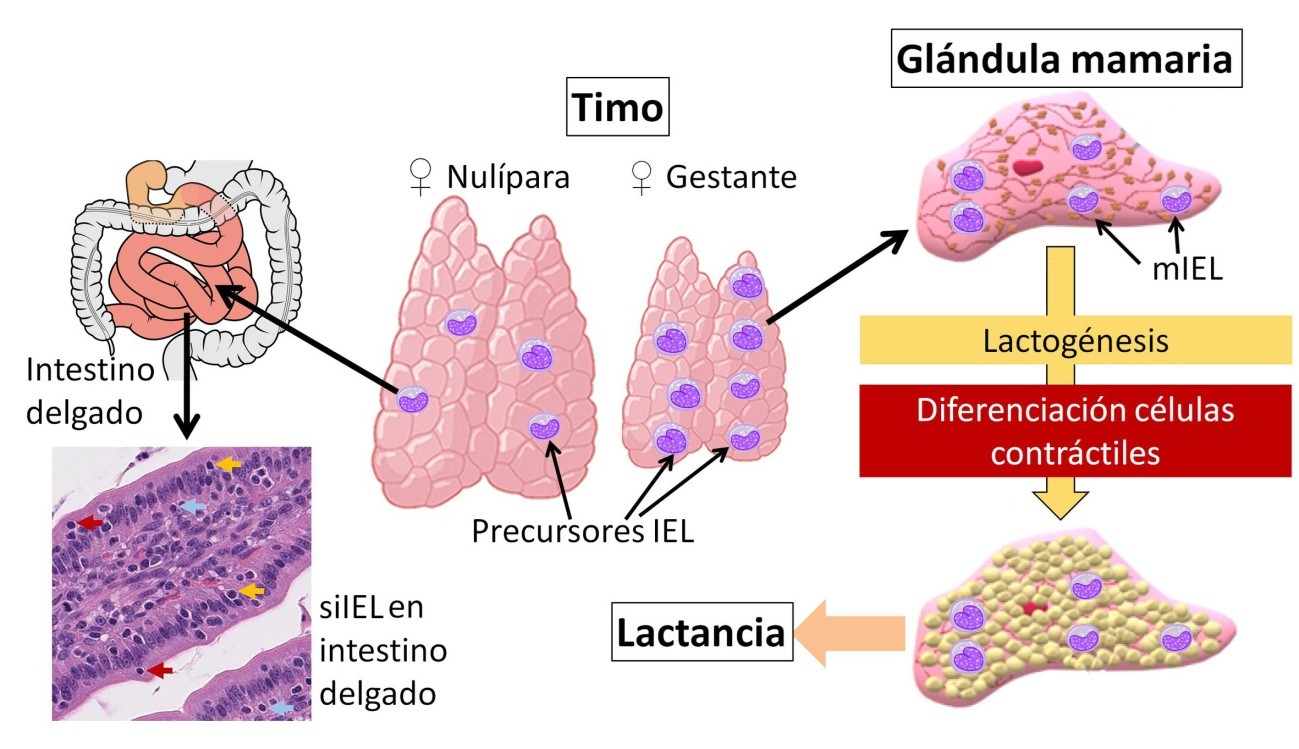
Precursoras de linfocitos T-bet del timo
Los investigadores confirmaron que los linfocitos T-bet procedían del timo. Esto era llamativo, ya que el timo involuciona durante la gestación, un fenómeno que se ha relacionado con la tolerancia inmunológica hacia los fetos. Sin embargo, el timo reducido de las ratonas gestantes mostraba un paradójico enriquecimiento en precursores de linfocitos T-bet (Figura 1).
Cuando los precursores de los T-bet se inyectaron en ratonas deficientes en linfocitos, el destino de las células resultantes fue diferente en función del estado de la ratona. Si la ratona no había gestado anteriomente, los T-bet se alojaron en el intestino delgado, convirtiéndose en siIEL (por small-intestine intraepithelial lymphocytes), un tipo especializado de células inmunitarias que residen en el epitelio del intestino delgado. Pero cuando los precursores T-bet se inyectaron en ratonas deficientes en linfocitos y gestantes, las células se dirigieron a las glándulas mamarias, donde se diferenciaron en los mIEL necesarios para la producción de leche (Figura 1).
Este resultado es sorprendente. Durante la gestación, el suministro normal de linfocitos intraepiteliales al intestino delgado por parte del timo se reorganiza y desvía, proporcionando linfocitos intraepiteliales a la glándula mamaria. Su función también cambia, de la defensa contra infecciones y regulación de la inmunidad intestinal, estos linfocitos pasan a ser activadores de la lactogénesis.
La doble función de los mIEL
En concreto, los mIEL realizan una doble función en la glándula mamaria. Por un lado, activan la síntesis de los componentes de la leche en el epitelio mamario. Por otro, promueven la diferenciación de células mioepiteliales con capacidad contráctil para impulsar el flujo de la leche (Figura 1). De ahí su importancia para la lactogénesis.
¿Son extrapolables estos resultados a la especie humana? Los autores del estudio piensan que es probable, ya que han localizado en la leche materna linfocitos con las mismas características de los mIEL, aunque será necesario confirmar esto. Lo que sí parece interesante es que este descubrimiento podría aclarar el origen de algunas anomalías en la lactogénesis humana. Todavía más importante, el descubrimiento de los mIEL podría explicar la protección parcial que parece conferir la lactancia frente al cáncer de mama. En efecto, diversos estudios sugieren que la frecuencia de este tipo de cáncer se correlaciona negativamente con la duración del amamantamiento. El grupo del NIH ha observado que los mIEL permanecen en la glándula mamaria del ratón una vez que la han colonizado, aunque hayan terminado de amamantar. Como se trata de células del sistema inmune con propiedades citotóxicas, se puede especular que su presencia sea una de las razones que explican esta protección contra el cáncer.
Referencia:
Corral, D., Ansaldo, E., Delaleu, J. et al. (2025) Mammary intraepithelial lymphocytes promote lactogenesis and offspring fitness. Cell. Doi: 10.1016/j.cell.2025.01.028.
Nota:
[1] Se trata de un tipo de linfocitos caracterizado por expresar el factor de transcripción TBX21.
Sobre el autor: Ramón Muñoz-Chápuli Oriol es Catedrático de Biología Animal (jubilado) de la Universidad de Málaga.
