Los parásitos son organismos que viven sobre o dentro de organismos hospedadores, de los que obtienen alimento y a los que causan perjuicios. En general, la interacción se limita a esta obtención de nutrientes, pero hay casos en los que los parásitos manipulan el comportamiento de sus hospedadores y obtienen beneficios adicionales para su reproducción o dispersión. Los interesados encontrarán aquí una excelente revisión sobre este tema.
Por ejemplo, ciertos gusanos nematomorfos infectan el cuerpo de grillos y mantis. Dado que necesitan completar su ciclo vital en el agua, cuando alcanzan la madurez inducen un “suicidio por ahogamiento” de su hospedador, como podemos ver en este vídeo. El parásito intracelular Toxoplasma hace que hospedadores como ratas, chimpancés o hienas pierdan el miedo a sus depredadores, aumentando la probabilidad de que sean devorados y extendiendo así la infección. Un hongo, Ophiocordyceps unilateralis, muy relacionado con el que vamos a tratar hoy, controla el comportamiento de las hormigas que invade, obligándolas a ascender a las partes superiores de plantas donde muerden fuertemente las hojas antes de morir. Su situación elevada facilita la dispersión de las esporas (Figura 1 y vídeo). Ophiocordyceps se ha hecho célebre recientemente, ya que una ficticia mutación de este hongo, que lo convierte supuestamente en patógeno humano y generador de zombis, es la base argumental de la popular serie The Last of Us.

Hoy nos ocupamos de otro hongo que manipula a su hospedador, normalmente una oruga, de forma insólita. Cordyceps militaris es un organismo bien conocido por su uso en medicina tradicional y gastronomía china (Figura 2). Parasita a las orugas, pero no las invade completamente ni las mata hasta que entran en fase de crisálida, es decir, la fase en la que experimentan la metamorfosis.

Un grupo de investigadores chinos ha descubierto que Cordyceps incrementa el ansia de alimento de los gusanos de seda a los que infecta, de forma que aumentan de peso alrededor de un 10% respecto de los no infectados. Esto es llamativo, porque las infecciones agudas normalmente implican pérdida de apetito y de peso. ¿Cómo manipula Cordyceps a su hospedador?
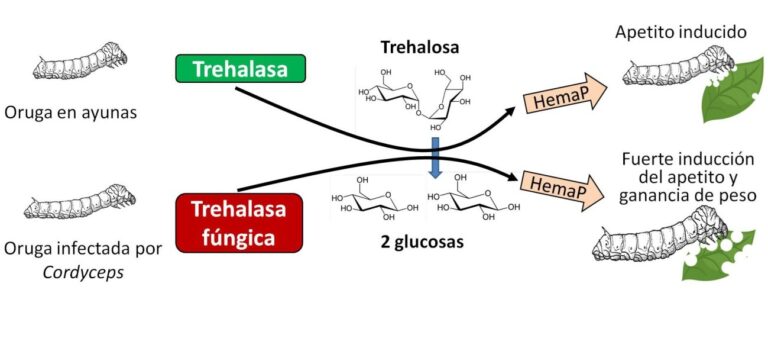
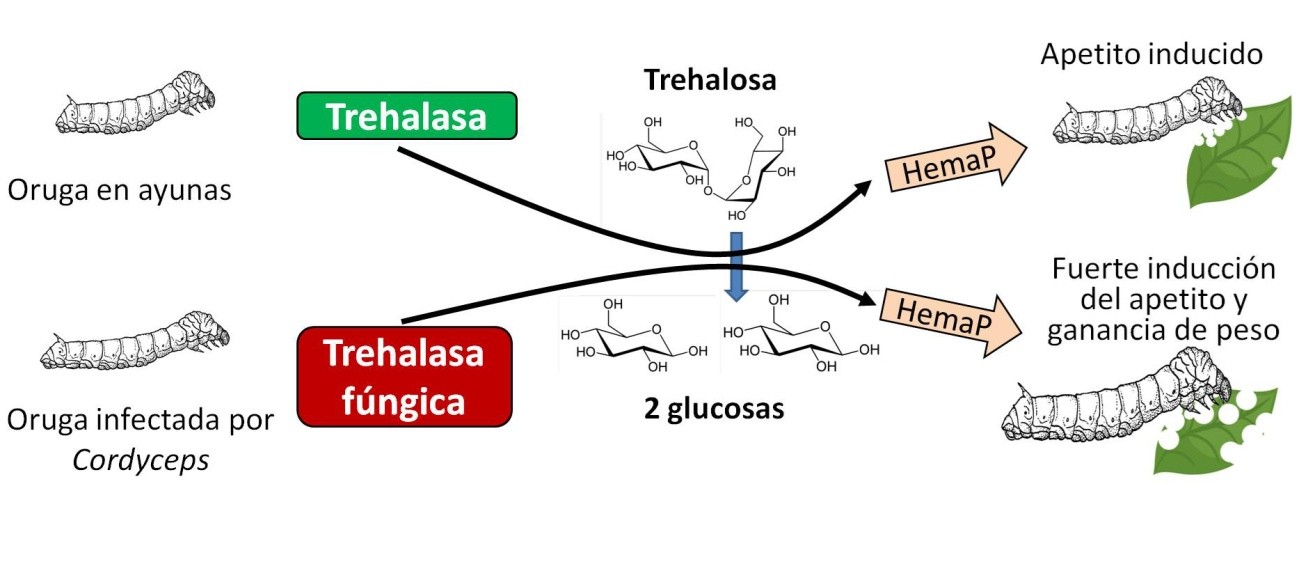
La investigación reveló que los gusanos infectados desplegaban respuestas fisiológicas similares a las de gusanos sometidos a ayuno forzoso. En concreto, se producía un aumento de la concentración en la hemolinfa (el fluido equivalente a la sangre) de HemaP, un péptido orexigénico, es decir, que incrementa el apetito. También disminuía en la hemolinfa un azúcar, la trehalosa, formado por dos moléculas de glucosa. Este azúcar, en concentraciones altas, inhibe el comportamiento alimentario y la expresión de HemaP.
La disminución de trehalosa en la hemolinfa de gusanos infectados, con la consiguiente respuesta “hambrienta”, se produce por el aumento de la enzima trehalasa, responsable de desdoblar la trehalosa y producir dos moléculas de glucosa (Figura 3). Lo más interesante es que esta enzima no solo estaba producida por el hospedador. El propio hongo secretaba una trehalasa muy similar a la del gusano. De hecho, el estudio sugiere que el gen de la trehalasa del hongo fue adquirido desde algún insecto por el fenómeno denominado transferencia genética horizontal (TGH). Ya tratamos en su momento otro caso de un parásito intracelular (la bacteria Wolbachia) que feminiza a sus hospedadores machos utilizando un gen “robado” por TGH.
Los experimentos mostraron que la modificación genética de los gusanos mediante CRISPR-Cas9 para bloquear HemaP, inhibía el aumento de peso de la crisálida infectada y disminuía la capacidad de formar el cuerpo fructífero productor de esporas. Si lo que se modificaba era el hongo, bloqueando el gen “robado” productor de trehalasa, también se evitaba el aumento de peso, e incluso aumentaba la supervivencia de las orugas infectadas.
Estos resultados indican que el hongo, en su evolución, incorporó en su genoma un gen de la trehalasa de insectos para reducir la concentración de trehalosa en el gusano infectado. Esto genera una reacción similar a la que provoca el ayuno, con aumento de HemaP. El gusano no para de tener hambre, a pesar de comer continuamente. Así acumula reservas para el momento en que, iniciada la fase de crisálida, el hongo lo invada, consuma sus tejidos y forme el cuerpo fructífero para dispersar sus esporas.
Referencias
Zhao, P., Lin, J., Yang, D. et al. (2025) Fungal pathogen promotes caterpillar feeding and weight gain using a host-like trehalase Curr. Biol. doi: 10.1016/j.cub.2025.06.002.
Sobre el autor: Ramón Muñoz-Chápuli Oriol es Catedrático de Biología Animal (jubilado) de la Universidad de Málaga.