Sergio P Acebrón
Igual que las piezas de un coche, las células que forman los tejidos de nuestros órganos necesitan ser reemplazadas tras un prolongado uso. Por ejemplo, las células de órganos como la piel o el intestino sufren un desgaste continuo y necesitan que otras ocupen su lugar mediante divisiones celulares cada pocos días. Otras, como las neuronas, apenas son reemplazadas. Una pregunta candente en la biología es cómo se organizan los diferentes tejidos dentro de los órganos para producir las células que son necesarias para su normal mantenimiento. Las células son tanto las piezas del engranaje como los ladrillos que sustentan el tejido. Si se obtienen pocas células llegará un momento que el órgano será consumido mientras que si se producen muchas se puede dañar la estructura del órgano, entre otras complicaciones como la aparición de tumores. Un ejemplo muy ilustrativo puede verse en esta impresionante animación sobre la continua regeneración celular del intestino.
Para poder mantener el tejido en condiciones optimas las células se comunican entre ellas mediante contactos directos y señales, en muchos casos hormonas y proteínas, que liberan al medio extracelular que las rodea. Estas señales forman un código complejo que permite a las células descifrar su posición en el tejido y que acciones deben tomar.
En los últimos años se han ido descubriendo muchas de las señales encargadas del mantenimiento de nuestros tejidos así como las células responsables de la reparación: las células madre adultas. Estas células son pluripotentes o oligopotentes, es decir pueden convertirse en todos o varios de los tipos celulares existentes en el tejido donde residen. (Figura 1)
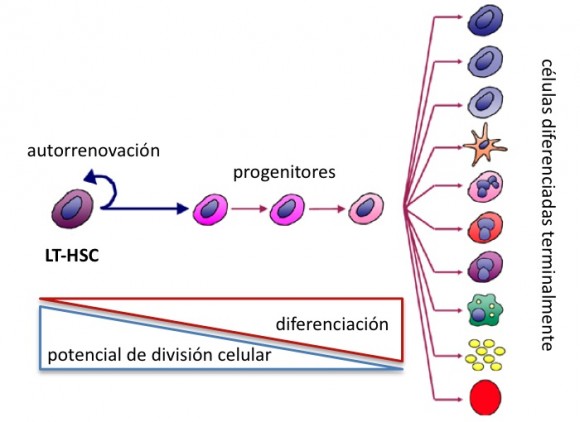
Las células madre adultas se apoyan sobre un manto celular denominado nicho que genera las señales que las mantienen en ese estado pluripotente y les indican cuando deben dividirse para producir nuevas células para el tejido. Estas divisiones se denominan asimétricas ya que una de las células hijas se volverá a convertir en una célula madre adulta mientras que la otra está destinada a seguir dividiéndose y a que su linaje regenere el tejido. Pero ¿Cómo se selecciona el destino de cada célula hija?
Una hipótesis muy atractiva es que el nicho sobre el que se mantienen las células madre adultas determina que célula hija tendrá cada destino: la célula hija más próxima al nicho tendría el destino de la madre mientras que la más lejana sería “expulsada” y acabaría formando otras células del tejido.
Esta hipótesis es difícilmente comprobable en condiciones de laboratorio dada la complejidad técnica del cultivo de tejidos u órganos completos en laboratorio. Una aproximación al problema consiste en utilizar células madre embrionarias que comparten muchas características con las células madre adultas pero que, al contrario de estas, pueden ser cultivadas fácilmente en el laboratorio.
Cuando las células madre embrionarias son tratadas con unas señales extracelulares denominadas proteínas Wnt3a son capaces de mantener su pluripotencia en cultivo[footnote]Berge D.T., Kurek D., Blauwkamp T., Koole W., Maas A., Eroglu E., Siu R.K. & Nusse R. (2011). Embryonic stem cells require Wnt proteins to prevent differentiation to epiblast stem cells, Nature Cell Biology, 13 (9) 1070-1075. DOI: 10.1038/ncb2314[/footnote]. Dentro de los tejidos estás proteínas Wnt3a participan también en el mantenimiento de las células madre adultas aunque son secretadas de forma polarizada por las células del nicho. Datos recientes sugieren que es posible conseguir esta polaridad en las células en cultivo al embeber nanoparticulas con proteínas Wnt3a y colocarlas solo en uno de los polos de las células madre embrionarias. Sorprendentemente la posición de las nanopartículas con Wnt3a determina el eje de división celular que tiende a ser perpendicular a la posición de la nanopartícula[footnote]Habib S.J., Chen B.C., Tsai F.C., Anastassiadis K., Meyer T., Betzig E. & Nusse R. (2013). A Localized Wnt Signal Orients Asymmetric Stem Cell Division in Vitro, Science, 339 (6126) 1445-1448. DOI: 10.1126/science.1231077[/footnote] (Figura 2).
![Figura 2: Secuencia de imágenes de microscopía confocal de fluorescencia. Solo se aprecian los cromosomas (naranja) de la célula madre embrionaria y la nanopartícula con proteínas WNT3A (azul). En la secuencia se observa que los cromosomas se alinean de forma perpendicular a la nanopartícula y que un juego de dichos cromosomas se dirige hacia la nanopartícula mientras que el otro, que formará la otra célula hija, se aleja. Fuente: [2].](https://culturacientifica.com/app/uploads/2013/11/figura2-1-580x145.png)
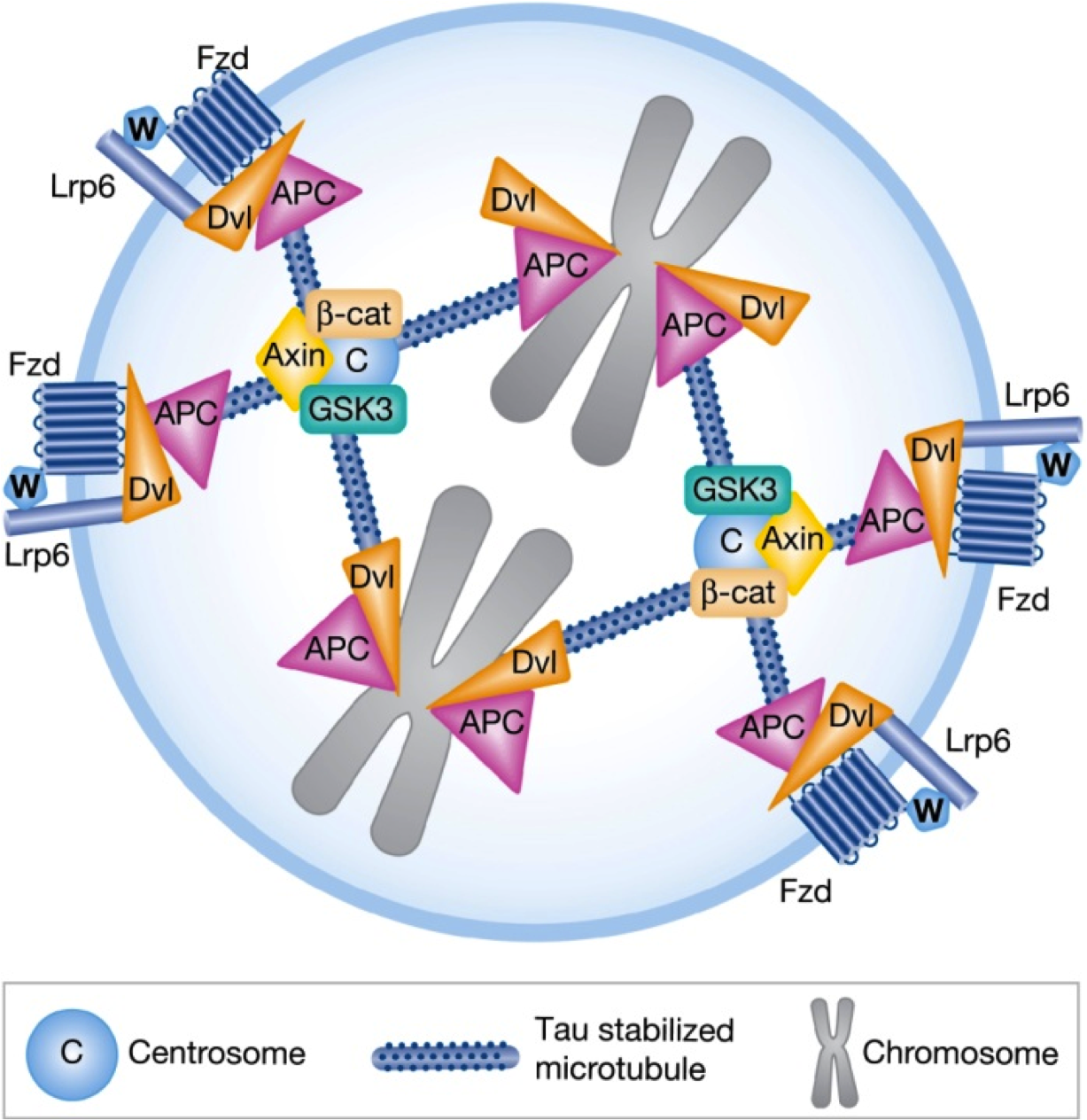
Varios componentes encargados de la recepción de señales Wnt3a se reorganizan y acumulan en el polo celular donde se encuentra la señal como parte del proceso de desciframiento. Aunque se desconoce al detalle el mecanismo implicado en este proceso, se sabe que dichos componentes son capaces de unir y “tirar” de la maquinaria celular encargada de segregar los cromosomas durante la división celular, de forma que el polo de Wnt3a se convierte a su vez en el polo de división[footnote]Niehrs C. & Acebron S.P. (2012). Mitotic and mitogenic Wnt signalling, The EMBO Journal, 31 (12) 2705-2713. DOI: 10.1038/emboj.2012.124[/footnote][footnote]Kikuchi K., Niikura Y., Kitagawa K. & Kikuchi A. (2010). Dishevelled, a Wnt signalling component, is involved in mitotic progression in cooperation with Plk1, The EMBO Journal, 29 (20) 3470-3483. DOI: 10.1038/emboj.2010.221[/footnote](Figura 3).
![Figura 3: Representación de una célula en división. Los diferentes componentes celulares encargados de la recepción de la señal Wnt3a (W) se organizan junto a la maquinaria encargada de repartir los cromosomas (gris) a las células hijas. En este ejemplo los componentes se distribuyen a ambos lados de los cromosomas, algo que no ocurre en células madre. Fuente: [3].](https://culturacientifica.com/app/uploads/2013/11/figura3-580x597.png)
Al fusionar la maquinaria de división con la de la pluripotencia se puede conseguir un doble efecto: solo una célula hija está cerca del nicho que produce Wnt3a, además hereda los componentes encargados de descifrar dicha señal (Figura 3) y por tanto de mantener la pluripotencia. La otra hija, alejada del nicho, y sin los componentes para interpretar la señal extracelular, queda condenada a diferenciarse. Expulsada para poder formar un nuevo linaje lejos de su antiguo hogar.
![Figura 4: Imágenes de microscopía de una célula madre embrionaria terminando su división. A la izquierda (DIC) se puede observar la célula vista a través del microscopio y que tiene unidas dos nanopartículas con Wnt3a. Las otras dos imágenes de fluorescencia de la misma célula muestran componentes involucrados en la recepción y transducción de Wnt3a (APC y b-catenin) que se acumulan solo en el polo donde se encuentran las nanopartículas (amarillo) y por tanto serán heredadas por la célula hija que acabe en dicho polo. El ADN se muestra en azul oscuro (DAPI) Fuente: [2].](https://culturacientifica.com/app/uploads/2013/11/figura4-580x188.png)
Sobre el autor: Sergio P. Acebrón (@acebron) es doctor en bioquímica por la UPV/EHU y actualmente trabaja como investigador en el German Cancer Research Center (DKFZ) en Heidelberg. Fue asesor científico del programa de televisión Escépticos (EITB), co-autor del libro de ensayo Actúa, y ha colaborado con El Heraldo de Aragón, El Correo, Naukas y Mapping Ignorance.
Juan Ituarte Tellaeche
Muy sugerente y fácil de entender (no de comprobar): «la célula hija más próxima al nicho tendría el destino de la madre mientras que la más lejana sería “expulsada” y acabaría formando otras células del tejido». Gracias.
Sergio P. Acebrón
Gracias Juan.
Al final es una solución sencilla y «mecánica», aunque no por ello menos bella, a un problema importante. Si las dos células abandonan el nicho para regenerar el tejido ocurriría, con el tiempo, que se acabarían la células madre para regenerarlo y el tejido se consumiría.
CooperacionIB
“: Historia de dos hijas – http://t.co/F4ird9FCnc http://t.co/gUpJLQSRAt”
Sergio P. Acebrón
Perdona, es el primer vídeo de este link: http://www.hubrecht.eu/research/clevers/research.html
petrinets
El link a la animación no parece funcionar, podeis linkarlo de nuevo?
Sergio P. Acebrón
Perdona, es el primer vídeo de este link: http://www.hubrecht.eu/research/clev…search.html
Sergio P. Acebrón
Perdona, es el primer vídeo de este link: http://www.hubrecht.eu/research/clevers/research.html