«Nanobiosensores: Aplicaciones en la frontera entre las nanociencias y la biomedicina» por Luis Liz-Marzán
Este texto de Luis Liz-Marzán apareció originalmente en el número 13 (2013) de la revista CIC Network y lo reproducimos en su integridad por su interés.
De entre las posibles aplicaciones de la nanotecnología en el ámbito de la salud, el diagnóstico presenta un gran potencial, ya que se pueden diseñar múltiples transductores que mejoren su rendimiento, tanto en sensibilidad como en localización. Los nanobiosensores se basan en nuevas propiedades que son características de los materiales en la escala nanométrica y que permiten optimizar la detección. Se espera de estas nuevas herramientas que permitan la detección temprana de enfermedades y la implantación de tratamiento y seguimiento a nivel personalizado.
La nanotecnología se ha establecido definitivamente como una disciplina con entidad propia en ciencia y tecnología. En una de las muchas definiciones posibles, la nanotecnología se ve como el “desarrollo de investigación y tecnología a niveles atómicos, moleculares o macromoleculares, en la escala de aproximadamente 1–100 nm, para obtener una comprensión fundamental de fenómenos y materiales en dicha escala nanométrica y para crear y usar estructuras, dispositivos y sistemas que tengan nuevas propiedades y funciones a causa de su tamaño”. Esto quiere decir que la clave no es la miniaturización, sino más bien los cambios que se producen en las propiedades físicas y químicas de los materiales cuando se dividen hasta la escala nanométrica. Debido al gran aumento de la proporción de átomos superficiales, propiedades como la conductividad eléctrica, el color, la resistencia mecánica, o el punto de fusión, entre otras, pueden variar radicalmente respecto a las del mismo material a escala macroscópica. Asimismo, en la escala nanométrica dichas propiedades varían notablemente con pequeños cambios de tamaño o geométricos y suelen ser muy sensibles a su entorno cercano, lo cual convierte a los nanomateriales en excelentes candidatos para la fabricación de sensores. Si somos capaces de manipular estos nanomateriales, podremos no solo modular su morfología sino también fabricar nuevos dispositivos cuya aplicación se base en estas nuevas propiedades.
Por otra parte, la mayoría de los procesos biológicos fundamentales también tienen lugar en la escala nanométrica, ya que biomoléculas como el ADN, las proteínas, los virus, etc., poseen dimensiones nanométricas, de forma que la interacción con nanopartículas puede ser tremendamente efectiva. Es pues esta frontera entre lo ‘bio’ y lo ‘nano’, la que define las posibles aplicaciones de nanopartículas y nanosistemas en el campo biomédico.
Nanopartículas para diagnóstico
En el campo de la ‘nanomedicina’ se suelen distinguir tres grandes áreas: diagnóstico, terapia y medicina regenerativa. De entre estas áreas, el ‘nanodiagnóstico’ ocupa una posición preferente, ya que es probablemente el área en la que se pueden obtener soluciones concretas a más corto plazo. El objetivo principal del ‘nanodiagnóstico’ es la identificación de enfermedades en sus etapas iniciales, cuando el desarrollo es todavía muy limitado, mediante la utilización de nanodispositivos o directamente de nanopartículas. De esta forma se podría tener una capacidad de respuesta más rápida, que ofrezca más posibilidades de terapia eficaz y recuperación completa. Los métodos de nanodiagnóstico se pueden utilizar in vivo o in vitro. El diagnóstico in vivo normalmente requiere que los nanodispositivos puedan penetrar en el cuerpo humano para identificar y (en el caso ideal) cuantificar la presencia de un determinado patógeno o de células cancerígenas, por ejemplo. Obviamente, esto requiere la biocompatibilidad del propio material, además de un diseño realmente sofisticado para asegurar su eficacia y minimizar los posibles efectos secundarios. Por su parte, el diagnóstico in vitro ofrece una mayor flexibilidad de diseño ya que se puede aplicar a pequeñas muestras de fluidos corporales o de tejidos, a partir de los cuales se puede llevar a cabo una detección específica (de patógenos o defectos genéticos, por ejemplo) en tiempos muy cortos, con gran precisión y sensibilidad.
A pesar de que existen ejemplos anteriores de productos comerciales para nanodiagnóstico (como los tests de embarazo), ha sido a lo largo de las últimas dos décadas cuando realmente se han hecho progresos espectaculares en este campo. Buena parte de dichos avances se basan en el control extremadamente preciso que se ha alcanzado en la fabricación y manipulación de nanopartículas con tamaños, geometrías y química superficial perfectamente definidas. Estos métodos de fabricación ponen a nuestra disposición nanopartículas de distintos tipos (semiconductoras, metálicas, magnéticas) que se pueden utilizar tanto como agentes de contraste para diagnóstico in vivo, como para diseñar biosensores para detección in vitro.
Diagnóstico in vivo: bioimagen
El diseño de nanopartículas para diagnóstico in vivo busca mejorar los niveles de contraste necesario para obtener una imagen, el cual se puede basar en distintos tipos de propiedades. Sin embargo, sea cual sea el tipo de nanopartículas utilizadas, se deben tener en cuenta una serie de cuestiones generales. Dado que el objetivo suele ser el reconocimiento de una anomalía en un órgano específico, las nanopartículas deben permanecer estables hasta llegar a su destino, reconocerlo de forma selectiva e, idealmente, eliminarse del organismo una vez realizada su función, a fin de evitar efectos secundarios. Por lo tanto, se debe evitar que las nanopartículas sean captadas por macrófagos antes de alcanzar el órgano afectado. Para ello, es necesario colocar ciertas moléculas en la superficie de las partículas que actúen como una capa de invisibilidad y de esa forma las escondan de los macrófagos, por ejemplo con polímeros como el polietilenoglicol. Una vez resuelto este problema, es preciso indicarles cómo localizar el tumor, lo cual requiere la unión de biomoléculas (biorreceptores) con afinidad selectiva hacia un compuesto específico de la zona a reconocer. Por ejemplo, ciertas proteínas se encuentran en mayor proporción en la membrana de las células cancerosas y son características de cada tipo de cáncer. Cuando las nanopartículas que llevan el biorreceptor se acercan a una célula que contiene dicha proteína, se produce una reacción de reconocimiento biomolecular, de forma que se acumularán allí, permitiendo la detección mediante una técnica adecuada a cada tipo de nanopartículas. La eliminación de las nanopartículas a través del hígado o los riñones parece ser bastante eficiente para tamaños pequeños, pero pueden surgir problemas relacionados con procesos de agregación, que es necesario resolver en algunos casos.
Uno de los primeros sistemas de nanopartículas que se han propuesto para aplicaciones de marcaje celular e identificación de zonas dañadas o tumores son las nanopartículas de semiconductores, también conocidas como puntos cuánticos (quantum dots). Cuando el tamaño de estos semiconductores se reduce a unos pocos nanómetros, su estructura electrónica se modifica, perdiendo la estructura de bandas característica y surgen niveles electrónicos discretos (cuantización). Esta nueva estructura electrónica les confiere propiedades de fluorescencia, cuyo color se puede modular a través del tamaño de la partícula. Por lo tanto, se pueden fabricar puntos cuánticos del mismo material que emitan luz en diferentes longitudes de onda (con distintos colores), con mayor estabilidad que las moléculas fluorescentes habituales, por lo que son extremadamente útiles como marcadores biológicos. Los semiconductores más utilizados son los de CdSe y CdTe, ya que se pueden producir en grandes cantidades mediante procesos químicos, con un control exquisito del tamaño que permite obtener bandas de emisión estrechas e intensas en una amplia variedad de colores y con un tiempo de vida muy prolongado. Todas estas características, a las que se puede añadir que la excitación de puntos cuánticos de distintos tamaños se puede realizar con una única lámpara (permitiendo así realizar marcajes múltiples de forma simultánea), han promovido su desarrollo como competencia a los marcadores moleculares fluorescentes habituales. Existen múltiples demostraciones del uso de puntos cuánticos para la localización de pequeños tumores, permitiendo así su extirpación inmediata. La Figura 1 muestra un ejemplo de localización inicial en el corazón y su seguimiento hasta que las partículas acaban acumulándose en el hígado.
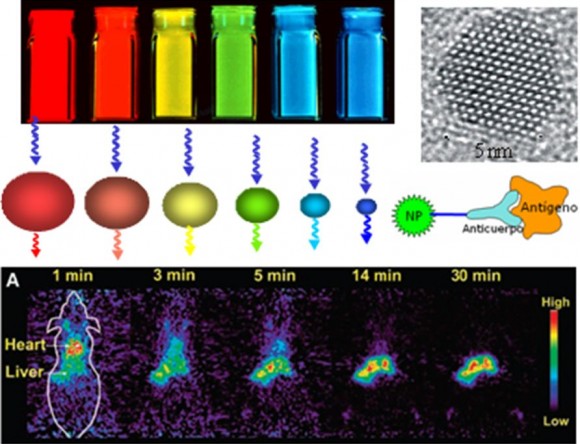
Con un esquema similar, se pueden utilizar también nanopartículas magnéticas como marcadores. El método de camuflaje y la introducción de agentes de reconocimiento serían idénticos, pero la técnica de detección es diferente. En este caso, las nanopartículas (típicamente óxidos de hierro como la magnetita) actúan aumentando el contraste en medidas de resonancia magnética de imagen. Estas nanopartículas podrían pues sustituir a los marcadores actuales, basados en metales pesados, reduciendo así su toxicidad. Idealmente, el carácter magnético de estos materiales podría facilitar su transporte a través del cuerpo mediante un campo magnético externo (un imán), pero no existen todavía pruebas concluyentes al respecto. Asimismo, se están desarrollando nanopartículas marcadas con isótopos radiactivos que permitan su detección mediante técnicas como la tomografía de emisión de positrones (positron emission tomography, PET) o la tomografía de emisión de fotones individuales (single-photon emission computed tomography, SPECT), ampliamente utilizadas como marcadores moleculares.
Biodetección con Nanometales
Las nanopartículas de metales nobles (principalmente oro y plata) presentan propiedades ópticas muy diferentes a las de los metales macroscópicos, ya que la luz puede provocar oscilaciones colectivas de los electrones que dan lugar a la absorción muy intensa de luz de un determinado color. Dado que esta interacción con la luz varía enormemente en función de las propias dimensiones del metal, se han planteado nuevos mecanismos de detección de tipo óptico. Estos efectos, que se denominan resonancias plasmónicas, son muy sensibles al tamaño y la geometría de las nanopartículas, lo cual permite diseñarlas para que absorban o dispersen luz en la región espectral que nos interese. Por ejemplo, se pueden fabricar nanopartículas de oro que sean muy eficientes absorbiendo o reflejando luz en el infrarrojo cercano (700 – 900 nm), donde los tejidos son más transparentes, de forma que la detección se pueda llevar a cabo incluso in vivo. Dado que la frecuencia de resonancia del plasmón superficial es muy sensible a variaciones en el índice de refracción cerca de la superficie, las nanopartículas metálicas pueden utilizarse también para diseñar biosensores para detección in vitro. En los biosensores se requieren dos elementos principales: un receptor biológico (por ejemplo proteínas, ADN…) preparado para reconocer específicamente una sustancia por interacciones biomoleculares y un transductor o sensor, capaz de interpretar el reconocimiento biológico y ‘traducirlo’ en una señal cuantificable. El fenómeno de resonancia plasmónica en nanopartículas se puede usar como transductor. Tal como se indica en la Figura 1, la adsorción de (bio) moléculas sobre las nanopartículas provoca cambios de color, que se pueden emplear para la detección, incluso al nivel de una sola partícula. Estos biosensores presentan la ventaja de que el sistema experimental es muy sencillo, ya que simplemente se mide la transmisión de luz, y además permite llevar la miniaturización hasta niveles extremos.
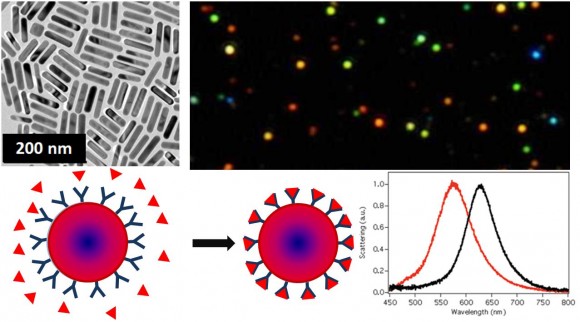
Debido a su pequeño tamaño, la oscilación de los electrones en las nanopartículas de oro y plata está muy localizada en ciertas zonas de las nanopartículas, dando lugar a campos eléctricos superficiales muy elevados (ver mapas de intensidad de campo en la Figura 3). Esto permite diseñar otros métodos de detección que hacen uso del fenómeno de resonancia plasmónica de una forma diferente. Una técnica que está adquiriendo una gran repercusión es la dispersión Raman aumentada en superficies (surface enhanced Raman scattering, SERS). En esta técnica, el campo eléctrico generado al excitar la resonancia plasmónica provoca un aumento de la señal de dispersión Raman de moléculas adsorbidas a su superficie en muchos órdenes de magnitud.
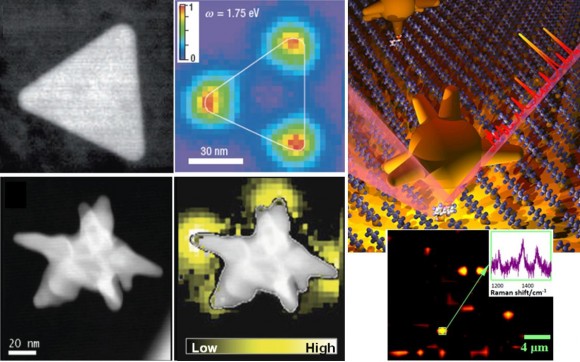
De esta forma se obtiene un aumento espectacular de la sensibilidad, que permite detectar cantidades extremadamente pequeñas de gran variedad de sustancias, llegando incluso a la detección de una única molécula. Un ejemplo se muestra en la Figura 3, en la que la unión de una ‘nanoestrella’ de oro a una molécula anclada a una superficie permite su identificación a través de su espectro SERS. Otros ejemplos son la detección de defectos puntuales en ADN o el reconocimiento de priones dañados, que son precursores de distintas enfermedades neurodegenerativas. A pesar del gran potencial que presentan estas técnicas, todavía es necesario resolver ciertos problemas técnicos antes de poder llevarlas al mercado.
Luis M. Liz-Marzán es director científico de CIC biomaGUNE, investigador Ikerbasque y catedrático -en excedencia- de Química Física en la Universidad de Vigo, donde ha dirigido durante más de 15 años el Grupo de Investigación de Química Coloidal. Es fellow de la Royal Society of Chemistry y la Optical Society of America, editor de la revista Langmuir, de la American Chemical Society, y ha obtenido importantes reconocimientos como el Premio Humboldt, el Premio DuPont de la Ciencia, el Premio de Química Física de la Real Sociedad Española de Química y, más recientemente, el Premio Burdinola y el ACS Nano Lectureship Award.
Edición realizada por César Tomé López a partir de materiales suministrados por CIC Network


“Nanobiosensores: Aplicaciones en la fron…
[…] Este texto de Luis Liz-Marzán apareció originalmente en el número 13 (2013) de la revista CIC Network y lo reproducimos en su integridad por su interés. De entre las posibles aplicaciones de la nanotecnología en el ámbito de la salud, el […]
Dionisio Carranza
Los felicito por todo lo que hacen por la ciencia esto es muy útil, especialmente para nuestro pais que esta en vías de desarrollo.
Gracias por toda esa información desde Honduras C.A.