«Construyendo el cerebro…, build it, and you understand it!» por Oscar Marín
Este texto de Oscar Marín apareció originalmente en el número 14 (2013) de la revista CIC Network y lo reproducimos en su integridad por su interés.
La corteza cerebral de los humanos es probablemente la estructura biológica más compleja que conocemos, y entender cómo funciona es uno de los retos más apasionantes de la ciencia. En medio de un intenso debate sobre cómo abordar este problema, la neurobiología del desarrollo persigue entender cuáles son las reglas fundamentales que dan lugar a la formación de los circuitos cerebrales, y cómo las alteraciones en el desarrollo de estos circuitos originan enfermedades como el autismo y la esquizofrenia.
La corteza cerebral es el tejido nervioso que recubre la mayor parte de nuestro cerebro. Es más, es prácticamente lo único que vemos de nuestro cerebro si lo observamos desde fuera. Está compuesta por varios miles de millones de neuronas, y para caber dentro del cráneo se pliega formando muchos giros y circunvoluciones. Algo así como lo que haríamos con una hoja de papel si quisiéramos meterla dentro de una bola de ping-pong.
Gracias a ella somos capaces de percibir el mundo que nos rodea, razonar y tomar decisiones, pero desafortunadamente no tenemos una idea muy precisa de cómo funciona. La corteza cerebral es la estructura del cerebro que más rápidamente ha cambiado durante la evolución, pero su organización general es básicamente la misma en todos los mamíferos, desde los roedores a los primates.
En ciencia se toman continuamente ideas prestadas de otros campos del conocimiento. Un ejemplo de este principio procede de la arquitectura contemporánea. El desarrollo del diseño arquitectónico moderno al comienzo del siglo XX trajo consigo el principio de que “la forma sigue a la función”, acuñado por el arquitecto americano Louis Sullivan. La idea es simple: la organización de una estructura u objeto se basa principalmente en su función o propósito. Los neurobiólogos han cooptado este principio en los estudios que correlacionan la función del sistema nervioso dentro de los confines de la neuroanatomía. Por ejemplo, el análisis de la corteza visual primaria realizado por el recientemente fallecido David Hubel y su colega Torsten Wiesel sugirió aspectos únicos del procesamiento de la información visual que fueron posteriormente confirmados de forma experimental. Durante los últimos años, esta idea se ha retomado con fuerza, y en la actualidad una parte importante de los esfuerzos encaminados a comprender la función de la corteza cerebral se basan en un conocimiento detallado de su estructura.
La corteza cerebral recibe este nombre porque es una estructura laminar, organizada en capas. La mayor parte de la corteza cerebral tiene seis capas de espesor, cada una de las cuales contiene neuronas que no son idénticas, pero comparten muchas características comunes. La corteza se organiza además a lo largo de su espesor, puesto que las neuronas que se encuentran superpuestas en diferentes capas (es decir, que forman parte de una misma ‘columna’ virtual de tejido) suelen estar interconectadas entre sí. Las dimensiones de estas columnas varían de unas áreas corticales a otras, pero de forma general mantienen un nivel de organización similar. Es decir, que la corteza cerebral se podría entender como una sucesión de módulos (columnas corticales) que se repiten muchas veces en cada área de la corteza.
Esto ha llevado a algunos científicos a sugerir -quizás de forma excesivamente optimista- que si comprendemos el funcionamiento de una columna de tejido cortical podríamos llegar a entender la actividad de la corteza cerebral en su conjunto. En la actualidad existen dos aproximaciones complementarias enfocadas a resolver la organización de la estructura cortical: una basada en el estudio de la caracterización de todas las conexiones que se establecen entre las neuronas de una columna de tejido cortical, y otra enfocada en la identificación de las reglas fundamentales que permiten su construcción, independientemente de que el resultado final pueda variar entre diferentes áreas corticales.
Modelar el cerebro
Nos encontramos inmersos en medio de un interesante debate mundial sobre si ha llegado el momento de poner en marcha un gran proyecto -la llamada big science– para modelar el funcionamiento de grandes áreas del cerebro como la corteza cerebral. Este tipo de proyecto se basa en el análisis masivo de la conectividad de las neuronas de una estructura concreta y, a partir de esta información, en la creación de modelos computacionales de su funcionamiento. La belleza de esta aproximación es su precisión y especificidad, pero es difícil imaginar que un modelo que implemente todos los detalles de la conectividad de todas las neuronas de una columna de tejido cortical sea excesivamente útil, ya que la construcción de estos modelos requiere una enorme cantidad de supuestos sobre otros parámetros del circuito, y estos parámetros pueden variar en función de los diferentes estados en los que se encuentre el cerebro.
Además, este tipo de proyectos han funcionado bien en el pasado cuando los objetivos estaban claramente definidos y la tecnología necesaria para su desarrollo era accesible a un gran número de laboratorios, como fue el caso del proyecto genoma humano. Esto no ocurre con las iniciativas que se han puesto en marcha recientemente en Europa (Human Brain Project) o en Estados Unidos (BRAIN initiative), donde el énfasis se encuentra, precisamente, en el desarrollo tecnológico y no tanto en la ciencia.
En cualquier caso, ¿cómo podemos modelar redes neuronales con suficiente nivel de detalle sin que el resultado sea tan difícil de comprender como los sistemas biológicos que los inspiran? Otra de las dudas que despiertan estos proyectos, basados en el estudio de la conectividad del cerebro adulto, es que difícilmente pueden reflejar los cambios adaptativos que ocurren de manera continua en el cerebro y a los que los neurocientíficos nos referimos de forma general como plasticidad neuronal. Además, aunque se afirma que el modelaje del funcionamiento de cerebro adulto podría ayudarnos a entender enfermedades como el autismo o la esquizofrenia, hoy en día sabemos que estos desórdenes surgen como alteraciones del desarrollo normal del cerebro y que precisamente el cerebro de los pacientes con estas enfermedades es diferente al de las personas sanas entre otras cosas por los cambios adaptativos que se producen en respuesta a los problemas surgidos durante el desarrollo. En otras palabras, no solo tenemos que entender cómo es el cerebro adulto “patrón” (es decir, el de los individuos sanos), sino cómo se forma y que desviaciones del patrón normal de desarrollo dan dar lugar a enfermedades.
El cerebro deconstruido
Richard Feynman, Premio Nobel de Física que participó en el proyecto Manhattan y desarrolló la electrodinámica cuántica, dejó escrita a su muerte una frase en la pizarra de su despacho que resumía su forma de entender la ciencia: What I cannot create, I don’t understand. Aunque el célebre científico probablemente no se refería al acto físico de construir algo, este principio se ha convertido en algo así como un ‘mantra’ de la ingeniería, según el cual entender cómo se ensambla un circuito eléctrico, por ejemplo, nos puede ayudar a entender como funciona. ¿Qué sabemos del desarrollo de la corteza cerebral que pueda ofrecernos pistas sobre su funcionamiento?
Desde un punto de vista reduccionista, la corteza cerebral contiene dos grandes tipos de neuronas, las células piramidales y las interneuronas. Las células piramidales constituyen aproximadamente el 80% de las neuronas en la corteza, son excitatorias, y se especializan en el procesamiento y la transmisión de información entre diferentes regiones corticales y entre la corteza y otras regiones del cerebro. Por otra parte, las interneuronas forman un grupo muy heterogéneo de neuronas que contribuyen principalmente a redes locales, proporcionan la actividad inhibitoria necesaria para controlar la excitabilidad de las células piramidales, y dan lugar a las diferentes formas de oscilaciones sincronizadas que coordinan la actividad de muchas neuronas piramidales de forma simultánea.
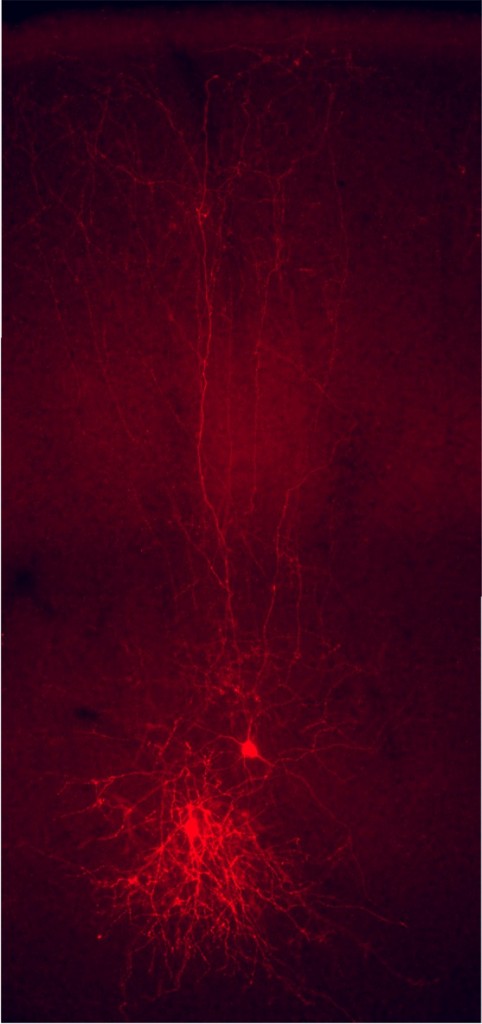
Los programas genéticos que se ponen en marcha durante el desarrollo permiten a los diferentes tipos de neuronas adquirir unas propiedades definidas, que van a influir notablemente en la función que desempeñan en los circuitos en los que participan. Por ejemplo, las células de Martinotti -una clase de interneuronas- influyen principalmente en las zonas alejadas de las dendritas de las células piramidales porque sus axones se dirigen sistemáticamente hacia la superficie de la corteza (Figura 1), donde se encuentran sus dianas. En los últimos años se ha descubierto que las células piramidales y las interneuronas, pese a formar parte de los mismos circuitos neuronales necesarios para la función de la corteza cerebral, siguen programas de desarrollo muy diferentes. De hecho, ambos tipos de neuronas se originan en regiones diferentes del tubo neural en desarrollo y, por lo tanto, tienen que seguir caminos distintos para alcanzar su posición definitiva en la corteza cerebral. Algo así como un club de fútbol moderno, compuesto por jugadores locales, de la cantera (las células piramidales), y jugadores importados de otros países (las interneuronas), que confluyen en un mismo equipo en el que se coordinan y se complementan. No está nada claro qué tipo de ventaja evolutiva se deriva de este origen dual de la corteza cerebral, pero este patrón de formación se conserva en todos los vertebrados actuales, incluidos los humanos.
Los programas genéticos que controlan el desarrollo de las células piramidales son muy diferentes de los que se activan en las interneuronas. Este descubrimiento tiene importantes implicaciones biomédicas, puesto que es concebible que existan variaciones genéticas que afecten independientemente a cada una de estas poblaciones de neuronas. Es decir, que pueden existir enfermedades que se deban fundamentalmente a defectos en las células piramidales y no a las interneuronas, y viceversa.
Por lo general, los defectos en el desarrollo de las células piramidales, que representan las tres cuartas partes de las neuronas de la corteza, tienen efectos devastadores y son incompatibles con la vida. Por el contrario, las alteraciones en el desarrollo de las interneuronas dan lugar a modificaciones más sutiles de la estructura cortical, y se relacionan de forma creciente con enfermedades como el autismo o la esquizofrenia.
En la actualidad estamos intentando comprender cuáles son los mecanismos que permiten que las células piramidales y las interneuronas confluyan en la corteza cerebral y formen circuitos específicos. Como no podría ser de otra forma, la corteza cerebral no contiene solo dos tipos de neuronas. En realidad, las células piramidales y las interneuronas constituyen dos grandes grupos de neuronas con características comunes, pero que a su vez agrupan a muchos tipos celulares diferentes, con características y funciones únicas. Así que el problema de entender los mecanismos que controlan su desarrollo se multiplica exponencialmente, ya que existen varias decenas de neuronas diferentes dentro de cada una de estas clases. El objetivo final, desde la óptica de la neurobiología del desarrollo, no es tanto saber cuáles son las conexiones exactas de cada tipo de neurona, sino comprender cuáles son las reglas básicas que regulan su establecimiento. Es decir, por qué unas neuronas se conectan con otras y no con cualquiera al azar, y hasta qué punto estas reglas son extrapolables a toda la corteza cerebral, y no sólo a una pequeña porción de la misma.
Se ha descubierto que las interneuronas siguen a clases específicas de células piramidales hasta su posición definitiva. Existe un código de señales -todavía desconocidas- que permiten que las interneuronas se coloquen en la capa de la corteza que les corresponde en respuesta a las células piramidales que forman esa misma capa. En modelos animales en los que la distribución de las células piramidales se altera, las interneuronas también se distribuyen de manera anormal por la corteza. Aunque todavía es muy pronto para ser concluyente, parece razonable pensar que este código que permite relacionar interneuronas con células piramidales concretas, y que por lo tanto determina el patrón general de conectividad que subyace a los circuitos corticales, se extiende hasta tipos específicos de neuronas. Es decir, que las neuronas están programadas genéticamente para establecer conexiones con otros tipos concretos de neuronas, y que este proceso se determina muy temprano en el desarrollo. Esto no quiere decir que dicho patrón sea inalterable, ya que la experiencia, fundamentalmente durante periodos críticos del desarrollo, es capaz de influir en la formación de las conexiones corticales y en la función de los circuitos, tal y como mostraron tan elegantemente Hubel y Wiesel.
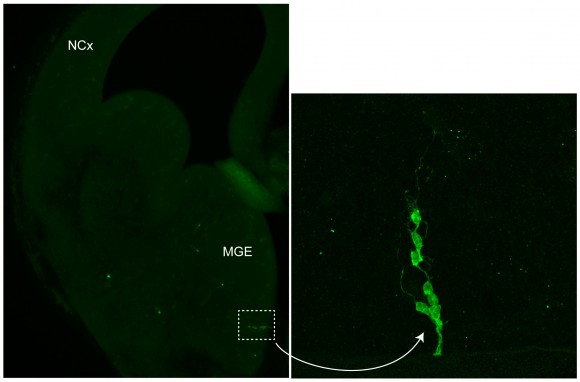
En nuestro laboratorio hemos descubierto recientemente que la localización de las interneuronas en la corteza puede estar incluso determinada desde antes de que estas células nazcan. En experimentos de marcaje de linajes, en los que podemos identificar un número muy pequeño de células progenitoras en el cerebro embrionario (Figura 2), hemos observado que las interneuronas que nacen de una misma célula progenitora tienden a ocupar una posición parecida en la corteza cerebral (Figura 3).
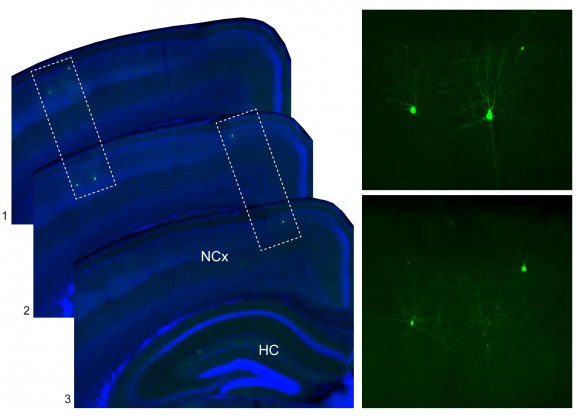
Es decir, que las células “hermanas” comparten la información necesaria para llegar a su destino, y por esta razón tienden a comportarse de una forma similar. De forma metafórica sería como si todos los pájaros de un mismo nido estuviesen de alguna manera determinados para ocupar una posición concreta de un cable del tendido eléctrico, que sería diferente del que ocuparían las aves procedentes de otro nido (Figura 4). Desde este punto de vista, y abusando de nuestra capacidad de reducir problemas complejos a cuestiones más simples, podríamos pensar que para entender cómo se organizan las interneuronas en la corteza cerebral bastaría con comprender cómo se ordenan sus progenitores.

Lo que nos gustaría comprender ahora es si las similitudes que existen entre las interneuronas del mismo linaje van más allá de su localización en la corteza, y se extienden, por ejemplo, a sus conexiones. ¿Conectan las interneuronas que proceden de un mismo progenitor con el mismo conjunto de células piramidales? ¿Se activan o inhiben a la vez en respuesta a un estímulo común? Éstas y otras preguntas forman parte de los proyectos de investigación que se desarrollan en estos momentos en nuestro laboratorio.
Conclusiones
El sistema nervioso del nematodo C. elegans contiene 302 neuronas, de las que conocemos tanto su desarrollo como cada una de las conexiones que efectúan. Sin embargo, todavía no sabemos cómo funciona el sistema nervioso de este pequeño gusano. Una de las cosas que hemos aprendido de este pequeño animal es que no todas las conexiones tienen el mismo peso para el desarrollo de una tarea concreta, es decir, que el mapa de conexiones de un circuito solo nos informa del rango de posibilidades existente. Esto quizás se deba a que la mayor parte de los circuitos neuronales codifican más de una posible solución. En otras palabras, las redes neuronales contienen muchos circuitos que pueden funcionar en paralelo, en función de la demanda. Si esto es así, es posible que tengamos que aprender mucho más que las reglas que permiten la asociación de unas neuronas con otras para poder predecir su función. Los próximos años serán claves para comprender la organización de la corteza y su funcionamiento. Pienso que la identificación de los patrones generales que subyacen a la organización de la corteza cerebral se conseguirá fundamentalmente gracias al estudio de su desarrollo.
Óscar Marín es profesor de investigación del Consejo Superior de Investigaciones Científicas (CSIC) en el Instituto de Neurociencias de Alicante, un centro mixto del CSIC y la Universidad Miguel Hernández. Miembro fundador del Consejo Europeo de Investigación (ERC), forma también parte del consejo editorial de la revista Science, y ha recibido numerosos premios y distinciones, como el Premio Banco Sabadell de Investigación Biomédica (2008) y el Premio Rey Jaime I de Investigación Básica (2011). El 1 de julio de 2014 Marín se incorporará como director del Centro de Neurobiología del Desarrollo del King’s College de Londres.
Edición realizada por César Tomé López a partir de materiales suministrados por CIC Network


rosalia sanchez
Viendo con mirada simple estas explicaciones de las neuronas… ¿se puede pensar que la esquizofrenia es totalmente genética? ¿ó pueden influir otras variantes externas en su evolución?
Rosalia Sanchez Ciganda
Complicado y apasionante. ¿podremos llegar a influir en la esquizofrenia? Esta enfermedad es totalmente genética? A nivel científico, ¿influyen en ella causas exteriores?
Marisa Castiñeira
Extraordinario el artículo . Me ha acercado y enseñado de esa complicada corteza cerebral. Su desarrollo; desde su origen embrionario, su expresión génica…..
Me ha incluso emocionado, gracias.
Marisa Castiñeira
Impresionante el artículo . Entender un poco más de esa complicada corteza cerebral.
Josefina Barrón Hernández
Excelente información, me gusta que a pesar de no ser especialista en el tema comprende uno muchas cosas durante la lectura.
“Construyendo el cerebro…, build it, and you understand it!” por Oscar Marín | CIC Network | Cuaderno de Cultura Científica | Blog de Ana María Palos
[…] “Construyendo el cerebro…, build it, and you understand it!” por Oscar Marín | CIC Network | …. […]
“Construyendo el cerebro…, build i…
[…] Este texto de Oscar Marín apareció originalmente en el número 14 (2013) de la revista CIC Network y lo reproducimos en su integridad por su interés. La corteza cerebral de los humanos es probablemente la estructura biológica más compleja […]