La Facultad de Ciencias de Bilbao comenzó su andadura en el curso 1968/69. 50 años después la Facultad de Ciencia y Tecnología de la UPV/EHU celebra dicho acontecimiento dando a conocer el impacto que la Facultad ha tenido en nuestra sociedad. Publicamos en el Cuaderno de Cultura Científica y en Zientzia Kaiera una serie de artículos que narran algunas de las contribuciones más significativas realizadas a lo largo de estas cinco décadas.
Transgénesis en mamíferos
En un artículo previo hemos tratado el tema de la tecnología del DNA recombinante (rDNA) y la transgénesis en bacterias. Continuando con esta temática, en este artículo nos centramos en la transgénesis en animales y, especialmente, en la transgénesis en mamíferos.
Un animal transgénico es aquél al que se le ha transferido un DNA exógeno (en muchas ocasiones de otra especie), el cual ha quedado integrado en el genoma de sus células germinales. Las células germinales son las que dan lugar a óvulos o espermatozoides, por lo que un animal transgénico puede transmitir el DNA exógeno a sus descendientes, a través de la reproducción sexual.
Inicialmente, los mamíferos transgénicos se crearon inyectando directamente un DNA exógeno en el núcleo de un óvulo fertilizado in vitro y manteniendo en cultivo el embrión resultante durante las primeras divisiones celulares, hasta implantarlo en una madre subrogada (Figura 1). Los primeros mamíferos transgénicos se produjeron en 1981, cuando científicos de la Universidad de Ohio introdujeron en ratones el gen de la hemoglobina de conejo.
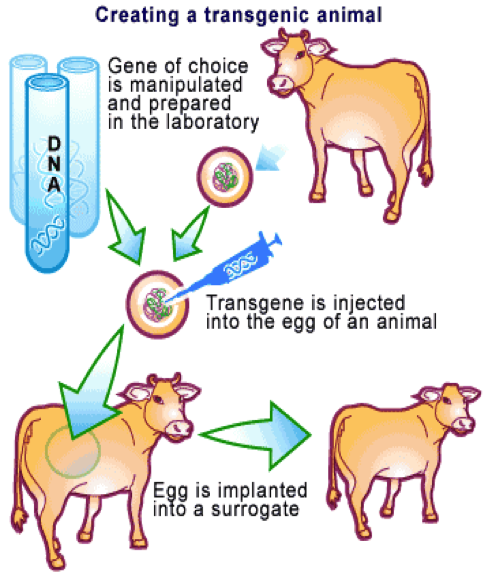
A partir de ese momento comenzaron a mejorarse las técnicas de fertilización in vitro y de inyección de genes en embriones de diferentes especies, para incrementar la eficacia de la generación de animales transgénicos.
Los motivos para crear este tipo de animales son diversos. En ocasiones se trata de conseguir aplicaciones de interés biomédico, como producir en la leche una molécula de utilidad terapéutica (anticuerpos monoclonales, interleukina-2, eritropoyetina, hormona de crecimiento humana, son algunos ejemplos de proteínas así obtenidas). Para este tipo de aplicación se suelen generar cabras, conejos, ovejas o vacas transgénicos. Otras aplicaciones están relacionadas con el uso de animales como donantes de tejidos u órganos; en este caso, los cerdos suelen ser la especie de elección y la transgenia pretende mejorar la compatibilidad del xenotransplante. También algunos animales se generan por interés comercial de la industria alimentaria, que busca generar animales resistentes a enfermedades, con una tasa de crecimiento más elevada, o con propiedades nutricionales modificadas y acordes a los intereses del mercado.
Además, existe un gran interés en la generación de animales transgénicos en el ámbito científico, donde se emplean para avanzar en el conocimiento molecular de las enfermedades, en la función de los genes o en el efecto de mutaciones concretas. Los modelos de animales transgénicos para enfermedades humanas están permitiendo no solo descubrir los aspectos moleculares responsables de las patologías, sino también disponer de herramientas para investigar la progresión de una enfermedad, o para evaluar estrategias terapéuticas de forma previa a su aplicación en humanos, entre otras aplicaciones. Sin ninguna duda, la especie preferida para este tipo de estudios es el ratón, debido a su bajo coste de mantenimiento, a su reducido período de gestación, a la relativamente estrecha relación evolutiva que existe entre su genoma y el genoma humano, y a la disponibilidad de cepas de ratones genéticamente puras con las que iniciar el procedimiento. Además, como se detalla a continuación, las tecnologías para la generación de organismos transgénicos están particularmente bien desarrolladas para la introducción de modificaciones genéticas en el ratón. Todo ello ha conducido a que el uso de ratones transgénicos sea una herramienta ampliamente utilizada en el ámbito de la investigación biomédica.
Transgénesis dirigida en ratones
A pesar de sus numerosas aplicaciones, la transgénesis mediante inyección nuclear descrita en la sección anterior presenta el inconveniente de que la integración de los transgenes exógenos en el genoma hospedante se realiza de manera aleatoria, lo cual puede generar efectos variables no deseados. En ratones, este inconveniente se solventó en 1988, cuando se consiguió generar un ratón mediante una metodología compleja que se ha denominado transgénesis dirigida porque permite introducir los transgenes en lugares específicos del genoma hospedante. El desarrollo de esta tecnología llevó a sus creadores, los Dres. Capecchi, Smithies y Evans a obtener el premio Nobel en 2007.
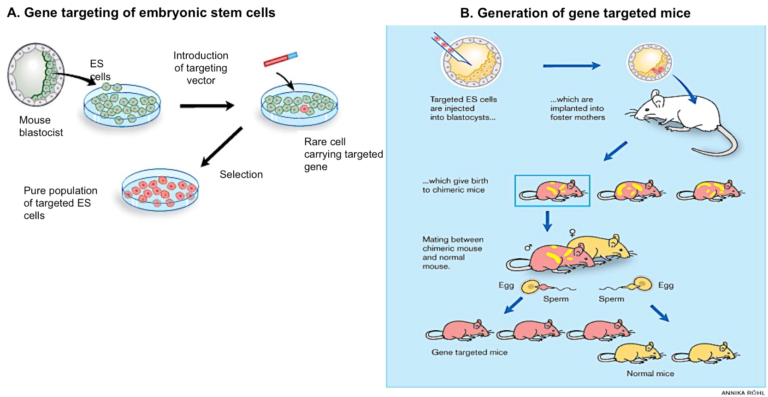
Para llevar a cabo la transgénesis dirigida se utilizan células madre embrionarias (ES, del inglés embryonic stem), un tipo de células que pueden mantenerse indefinidamente in vitro en un estado no diferenciado pero que, cuando se inyectan en un embrión, contribuyen a la formación de todos los tejidos del ratón en desarrollo. Las células ES en cultivo, se someten a un tipo de modificación genética, denominada recombinación homóloga, mediante la cual el transgén de interés se integra en un punto concreto de su genoma. A pesar de que la recombinación homóloga es poco eficaz, las células ES en las que el proceso ha sucedido correctamente pueden seleccionarse e incrementar su número mediante su cultivo in vitro (Figura 2A).
Posteriormente, las células ES seleccionadas que contienen el transgén correctamente insertado, se inyectan en un embrión de ratón en etapa muy temprana de su desarrollo (blastocisto), dando lugar a un ratón quimérico que contiene células no modificadas y células ES modificadas genéticamente. Si este ratón quimérico porta la modificación genética en su línea germinal (óvulos o espermatozoides) la podrá transmitir a su descendencia, generándose así, en la siguiente generación, ratones con todas sus células modificadas. (Figura 2B).
Esta tecnología se utiliza frecuentemente para producir mutantes nulos, también llamados «knockouts» (KO), es decir, ratones que presentan un gen anulado y que no producen una determinada proteína. El objetivo de esta estrategia es identificar la función de un gen, observando el efecto que se obtiene cuando se elimina. Nuestro grupo de investigación ha venido participando activamente en la generación y caracterización de ratones knockout para genes implicados en el control del ciclo celular (genes E2f1 y E2f2). Los resultados de estas investigaciones han permitido demostrar que los genes E2f desempeñan un papel esencial en la homeostasis del animal, al prevenir el desarrollo tumoral (E2f1), la autoinmunidad (E2f2) o la degeneración glandular (E2f1 y E2f2).
Actualmente, no existe una cifra exacta del número de ratones modificados genéticamente que se han generado hasta la fecha, aunque a buen seguro se trata de varios miles. La mayoría de ellos están siendo empleados como modelos de estudio para un mejor conocimiento de la fisiología y patología humanas y para analizar el efecto molecular de alteraciones que han sido descritas como responsables de numerosas enfermedades humanas
Edición de genes mediante CRISPR
En el año 2012, las investigadoras Jennifer Doudna y Emmanuelle Charpentier comunicaron el desarrollo de una poderosa y nueva metodología, llamada edición génica (o genómica), basada en conocimientos básicos previos, aportados fundamentalmente por el investigador español Francisco Martínez Mojica, sobre un sistema de defensa que poseen la mayoría de las bacterias y de las arqueas denominado CRISPR (del inglés, clustered, regularly interspersed palindromic repeats).
La metodología CRISPR, que permite modificar genes de manera más precisa y rápida que la mayoría de los métodos anteriores, incluye el uso de varias moléculas que deben ser administradas a las células que se quieren editar, así como la intervención de los sistemas de reparación que existen en las propias células.
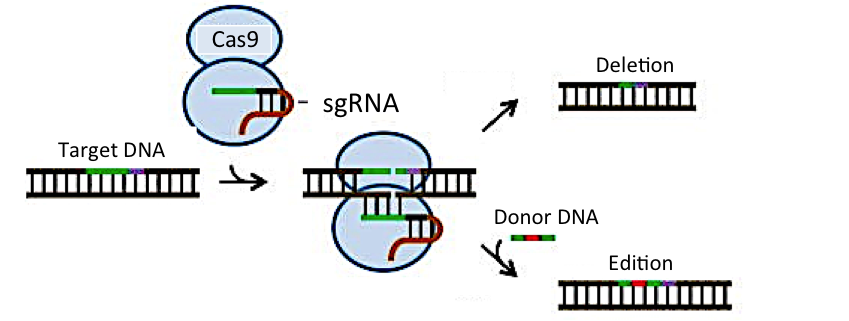
El proceso consiste básicamente en utilizar una proteína que corta el DNA, denominada Cas9, y un RNA guía, complementario a la región del genoma que se quiere modificar (Figura 3). Con estos elementos, se consigue cortar el genoma de las células en los lugares deseados. La reparación de la rotura por parte de las propias células genera con frecuencia deleciones o inserciones de 1-2 nucleótidos que conducen a la inactivación del gen en el que se ha producido esa rotura. Por otra parte, si junto con la enzima Cas9 y el RNA guía se aportan moléculas de DNA con secuencias diseñadas específicamente para un objetivo determinado (por ejemplo, la introducción de una mutación puntual), se puede conseguir la sustitución de la secuencia original por la secuencia diseñada.
La técnica CRISPR está suponiendo una verdadera revolución: en el año 2018, solo seis años después de la primera publicación, ya eran más de 17.000 los artículos publicados. Los motivos de esta rápida expansión en el uso de esta tecnología tienen que ver con que constituye un método directo, rápido y tremendamente eficiente para generar animales transgénicos: se trata de una técnica mucho más precisa que todas las utilizadas hasta ahora (aunque no lo es al 100%), más eficaz (un porcentaje elevado de las células tratadas pueden ser editadas), más rápida y más barata. Todo ello ha contribuido a “democratizar” su uso y a que una gran proporción de los laboratorios que trabajan en Biología Molecular la utilicen para sus investigaciones, tanto a nivel celular como para la generación de animales modelo, entre otras aplicaciones. Nuestro equipo de investigación también se ha sumado al uso de esta tecnología, habiendo generado ya varias líneas celulares que portan mutaciones específicas en los genes E2F para su empleo en estudios del ciclo celular y cáncer.
Además, la técnica CRISPR tienen ventajas adicionales, por ejemplo, permite modificar varios genes simultáneamente. El investigador Rudolph Jaenisch fue el primero en mostrar el poder de CRISPR para generar knockouts de ratón. En un artículo de 2013 su equipo publicaba la generación de un ratón al que le habían anulado cinco genes simultáneamente, mediante el empleo de esta técnica. Y lo que es aún más importante, demostraron que podían hacerlo sin necesidad de utilizar las células ES, eliminando directa y simultáneamente los cinco genes en zigotos unicelulares o en óvulos fertilizados de ratón. Se estima que diseñar un ratón mediante CRISPR es un 30% más barato que con células ES, lo que hace que su costo promedio actual sea de alrededor de 10.000€.
A pesar de su enorme utilidad, la técnica de CRISPR no está exenta de potenciales problemas, que incluyen la modificación accidental de regiones no específicas del genoma o la aparición de reacciones inmunológicas. Actualmente se está trabajando de forma muy activa para solventar estos inconvenientes, a fin de que la técnica CRISPR sea más precisa, segura y barata para la generación de animales transgénicos y para otras aplicaciones experimentales, pero sobre todo, para que su aplicación a los seres humanos pueda realizarse con las mayores garantías posibles. El siguiente artículo de esta serie trata, justamente, sobre la utilización de la tecnología del rDNA y de CRISPR en humanos.
¿Plantea problemas éticos la transgénesis?
La transgénesis en animales, y especialmente en mamíferos, tiene importantes implicaciones éticas relacionadas fundamentalmente con el bienestar de los animales transgénicos que se generan. Esta cuestión es especialmente importante cuando se busca conseguir un animal modelo para una patología humana que conlleva severos problemas de salud también para el animal. Por ejemplo, investigadores de la Academia China de Ciencias en Shanghai han obtenido recientemente 5 macacos transgénicos a partir de un ejemplar editado mediante CRISPR, para portar una versión alterada de un gen implicado en la regulación del ciclo circadiano (los ritmos biológicos asociados a los cambios de luz y de temperatura). En humanos, los trastornos del ciclo circadiano se asocian a alteraciones del sueño, depresión, diabetes mellitus, cáncer y enfermedades neurodegenerativas como Alzheimer. Los macacos obtenidos tras la modificación y posterior clonación, presentan alteraciones del sueño, ansiedad, depresión y conductas similares a la esquizofrenia. Como modelo para el estudio de este trastorno, estos monos pueden resultar muy útiles, pero es evidente que su bienestar se encuentra comprometido.
Parece claro que, a medida que la tecnología avance, las posibilidades para generar nuevas aplicaciones que afecten al bienestar de los animales también van a aumentar, así que urge adoptar medidas consensuadas por la sociedad, que permitan la toma de decisiones éticas sobre qué aplicaciones son asumibles y cuáles no.
Sobre los autores: Ana I. Aguirre, José Antonio Rodríguez y Ana M. Zubiaga son profesores del departamento de Genética, Antropología Física y Fisiología Animal de la Facultad de Ciencia y Tecnología, e investigadores del grupo de investigación consolidado del Gobierno Vasco Biología Molecular del Cáncer.