Antes de que se empezasen a fabricar baterías de litio ya se fantaseaba con la idea de poder hacer baterías de litio. La razón es que el litio es un metal que tiene tendencia a desprenderse de su electrón más externo. Al fin y al cabo, la electricidad es el tránsito de electrones, así que para producir electricidad necesitamos sustancias que tiendan a desprenderse de ellos.
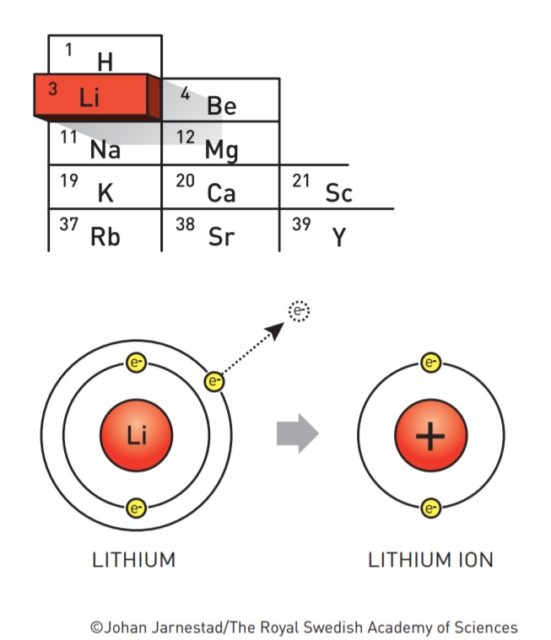
El litio es el metal con el menor potencial de reducción (-3,05V). Esto significa que es el elemento químico que más tendencia tiene a regalar electrones. Cuando regala su electrón más externo, el litio se queda cargado positivamente. Lo representamos como Li+ y lo llamamos ion litio. De ahí que las baterías de litio también se llamen baterías de ion-litio.
Que el litio ceda electrones con tanta alegría obviamente es una ventaja, pero al mismo tiempo es una maldición. Cede electrones a cualquiera. Al aire, al agua, a todo. Esto significa que es un metal muy inestable, que se oxida rápidamente en contacto con el aire, y que en contacto con el agua reacciona de forma violenta. Esa es la razón por la que la historia de las baterías de litio no ha sido un camino de rosas.
Las baterías tienen todas un mismo esquema fundamental:
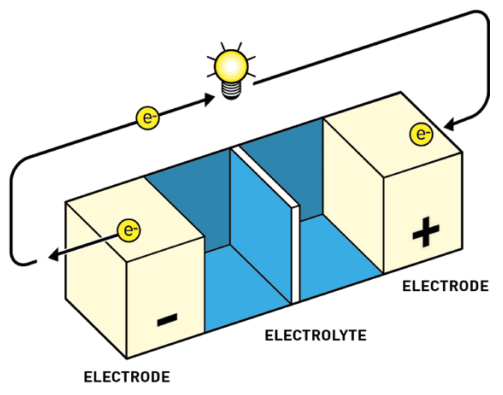
- Ánodo o electrodo negativo. Aquí es donde alguna sustancia se desprende de electrones. A estas reacciones de pérdida de electrones las denominamos reacciones de oxidación. Por convenio, al representar baterías o pilas el ánodo se dibuja a la izquierda.
- Cátodo o electrodo positivo. Aquí es donde alguna sustancia acepta los electrones. A estas reacciones de captura de electrones las denominamos reacciones de reducción. Es la reacción inversa a la oxidación. Por convenio, al representar baterías o pilas el cátodo se dibuja a la derecha.
- Electrolito. El electrolito actúa como separador entre el cátodo y el ánodo. Sirve para mantener el equilibrio entre las cargas del ánodo y el cátodo, ya que, si los electrones fluyen de ánodo a cátodo, se produce una diferencia de potencial, algo así como una descompensación de cargas, que frena el flujo de más electrones. El electrolito permite el flujo de iones (no de electrones) que reequilibran la carga entre ambos lados.
El ánodo y el cátodo están unidos en la batería por medio del electrolito. También se unen por fuera por medio de un conductor externo a través del cual solo circulan electrones. El conductor tiene dos extremos, polo positivo y polo negativo, como cualquier pila. Así que por el electrolito fluyen los iones de litio de un extremo a otro, y por el conductor externo fluyen los electrones.
En las baterías recargables las reacciones de oxidación (ceder electrones) y reducción (captar electrones) son reversibles, pueden fluir en ambas direcciones.
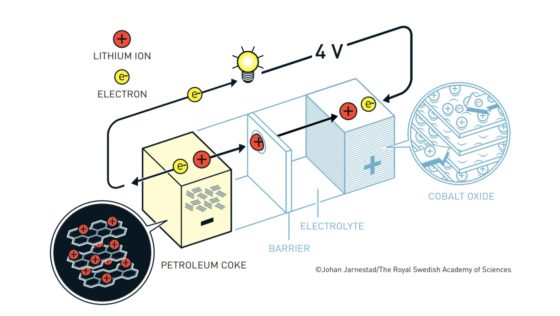
Las baterías de ion litio actuales más habituales tienen un cátodo de óxido de cobalto y un ánodo de un material similar al grafito denominado coque. Tanto el cátodo como en el ánodo tienen una disposición laminar en la que pueden albergar al litio. El litio viajará de cátodo a ánodo o de ánodo a cátodo a través del electrolito según el ciclo de carga o descarga. Los electrones, en cambio, circularán a través de un circuito externo.
Esto es lo que ocurre cuando se usa la batería
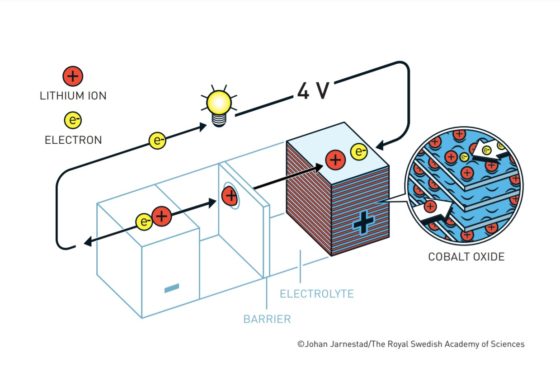
Cuando la batería está cargada, todo el litio está en el ánodo de coque. Durante la descarga los iones fluyen a través del electrolito desde el ánodo de coque hacia al cátodo de óxido de cobalto-litio. Los electrones también fluyen desde el ánodo al cátodo, pero lo hacen a través del circuito exterior, alimentando el móvil, el ordenador o el coche.
Como los iones de litio en el coque están a un potencial electroquímico más alto que en el óxido de cobalto-litio, caen desde el potencial del ánodo al potencial del cátodo. Esa es la razón por la que la batería aporta energía al aparato al que esté conectada.
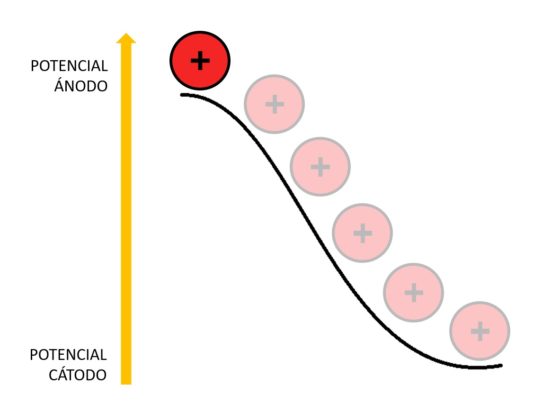
El voltaje ofrecido por la batería depende de la diferencia de potencial entre el cátodo y el ánodo. Cuanto mayor sea esta diferencia, mayor voltaje obtendremos.
Cuando todos los iones de litio llegan al cátodo, la batería estará completamente descargada.
Esto es lo que ocurre cuando cargamos la batería
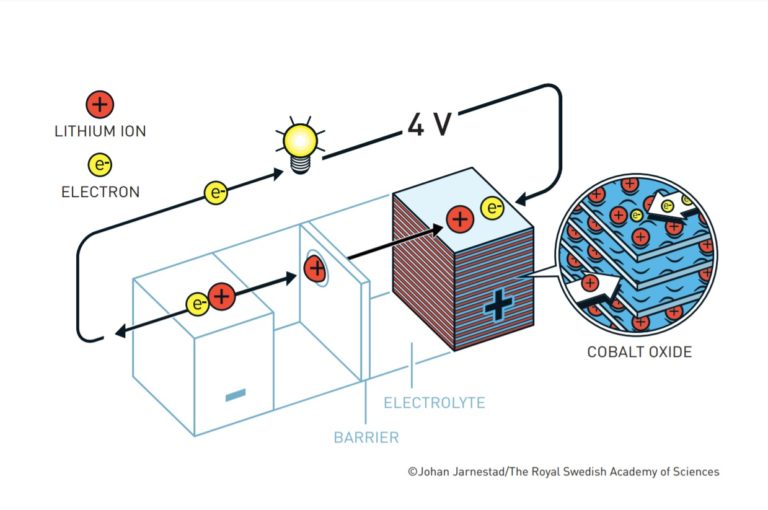
La carga de la batería se realiza conectando la batería a una fuente de energía externa como la red eléctrica. Los electrones de la red eléctrica entran en el ánodo a través del circuito externo. Esto provoca que los iones de litio abandonen el cátodo y regresen al ánodo a través del electrolito. Tanto los electrones como los iones litio se quedan acomodados en el ánodo entre las diferentes capas de coque. Cuando no fluyen más indica que la batería está completamente cargada.
La batería almacena energía en este proceso porque el potencial electroquímico del coque es más elevado que el del óxido de cobalto-litio. Esto quiere decir que los iones de litio han tenido que subir desde el potencial del cátodo hasta el potencial del ánodo.
La evolución de las baterías de litio
A lo largo de la historia se han creado diferentes baterías. La de Volta, de 1800, usaba como electrodos zinc y cadmio, llegando a obtener hasta 1,1 V. Las baterías de plomo-ácido que hoy en día se utilizan en muchos coches producen 2 V cada una. Se suelen colocar 6 para producir los habituales 12V. También hay baterías de níquel-hierro (NiFe), de niquel-cadmio (NiCd), de níquel-hidruro metálico (NiMH)…
El problema que presentan estas baterías es que contienen metales tóxicos como el plomo o el cadmio. Además, ofrecen densidades energéticas relativamente bajas. Cuanto mayor sea la densidad de energía, más energía habrá disponible para acumular o transportar (por volumen o por masa). Así, las baterías de plomo-ácido ofrecen 30 Wh/kg de densidad energética, las de NiFe 40 Wh/kg, las de NiCd 50 Wh/kg y las de NiMH 80 Wh/kg. En cambio, las de ion litio ofrecen al menos 120 Wh/kg y un voltaje mayor, de 4,2 V. Hay que tener en cuenta que las pilas alcalinas clásicas, las AA, solo ofrecen 1,5 V. Por eso las baterías de litio son tan compactas y los teléfonos móviles se han aligerado tanto.
El boom en la carrera investigadora de las baterías de litio se desató en los 70 a causa de la crisis del petróleo. Estaba claro que el ánodo perfecto tendría que ser de litio. Ahora faltaba descubrir el cátodo perfecto.
La primera batería de ion litio tenía un cátodo de sulfuro de litio y titanio (LixTiS2) que era capaz de acomodar en su interior los iones de litio que llegaban desde el ánodo. El ánodo era de litio metálico, y el electrolito era de LiPF6 disuelto en carbonato de propileno. En este electrolito el litio estaba protegido tanto del agua como del aire, ganando estabilidad. Así se lograban 2,5 V. La primera batería de litio comercial fue una evolución de esta, desarrollada por la empresa Exxon. En ella se usaba litio como ánodo, TiS2 como cátodo y perclorato de litio (LiClO4) disuelto en dioxolano como electrolito.
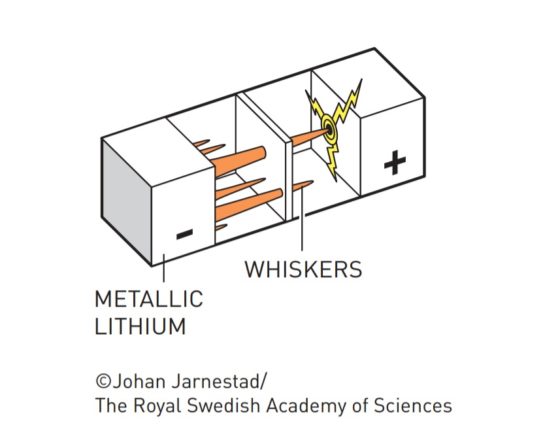
Pero se encontraron con un problema: cuando estas baterías se sobrecalentaban, llegaban a explotar. Descubrieron que lo que ocurría es que tras cada ciclo de carga y descarga se iban formando dendritas de litio que traspasaban la barrera de electrolito hasta llegar al cátodo, produciendo así un cortocircuito.
El problema parecía resolverse usando un ánodo diferente. En lugar de un sulfuro metálico, se probó con un óxido metálico, en concreto el dióxido de cobalto (CoO2) que, combinado con el litio se denomina óxido de cobalto-litio (LiCoO2). El LiCoO2 tiene un potencial de reducción tan alto, que ni siquiera hacía indispensable el uso de litio metálico puro como ánodo, sino que podría usarse otra sustancia que acomodase al litio de forma más estable y segura.
La respuesta llegaría en 1985 de la mano de la corporación japonesa Asahi Kasei. Descubrieron que el coque de petróleo —un sólido carbonoso derivado del refinado del petróleo— era capaz de acomodar al litio de forma muy eficiente. En muchos textos se le llama grafito. Es cierto que se le parece, pero no es exactamente grafito, sino un material de carbono que presenta dominios cristalinos grafíticos —en capas— y dominios no cristalinos. Entre unos y otros se acomodan los iones de litio.

En 1991, la empresa Sony, en colaboración con Asahi Kasei, sacaron a la venta la primera batería ion litio comercial con ánodo de óxido de cobalto-litio y cátodo de coque. El hecho de que los iones de litio entren y salgan ordenadamente en el ánodo y en el cátodo, forzados por las estructuras bidimensionales del coque y del óxido del cobalto, garantiza que las baterías apenas tengan efecto memoria. Es decir, las podemos cargar sin esperar a que se hayan descargado completamente sin miedo a que la batería se vicie.
En la actualidad se producen baterías de litio con cátodos todavía más eficientes. Como el cobalto es un elemento químico caro y relativamente escaso, el óxido de cobalto-litio se ha sustituido por el de fosfato de hierro-litio (LiFePO4) haciéndolas más baratas de producir. Se conocen como LFP, y adoptan estructuras cristalográficas diferentes. La de LFP con estructura tipo olivino es la que en la actualidad comercializa Sony. Puede durar 10 años si se carga a diario, cuando normalmente no sobrepasaban los 3-4 años. También tienen carga rápida, ya que en 2 h cargan el 95% de su capacidad.
En 2019 el desarrollo de las baterías de ion litio logró el Premio Nobel de Química repartido a partes iguales entre el alemán John B. Goodenough, el británico M. Stanley Whittingham, y el japonés Akira Yoshino. Whittingham fue quien lideró la investigación en la electrointercalación de iones de litio en disulfuros metálicos en los años 70. John Goodenough, que trabajó para Exxon, en los años 80 fue quien propuso la solución a que las baterías explotasen cuando se calentaban. Lo resolvió con el cátodo de óxido de cobalto-litio. Akira Yoshino, que trabajaba para la Corporación Asahi Kasei, en 1985 propuso el ánodo de coque.
La investigación actual en baterías de ion-litio se fundamenta en mejorar su eficiencia y el número ce ciclos de carga y descarga que pueden soportar. Se está experimentando con baterías de dióxido de carbono y litio, aunque hay expertos que aseguran que el futuro estará en el litio-grafeno.
Referencias
- They developed the world’s most powerful battery. Nobelprice.org.
- Scientific Background on the Nobel Prize in Chemistry 2019 LITHIUM-ION BATTERIES. Nobelprize.org.
- Baterías de iones litio, ¿cómo son?. Por Ignacio Mártil en CdeComunicación
- Premio Nobel de Química 2019: Goodenough, Whittingham y Yoshino por las baterías de ión-litio. Por Francis Villatoro en La ciencia de la mula Francis.
Sobre la autora: Déborah García Bello es química y divulgadora científica
Manuel Solis
Me ha parecido una explicación muy clara y sencilla del funcionamiento interno de este tipo de baterías, sin adentrarse en reacciones químicas complejas.
Ha sido un planteamiento muy didáctico para comprender estas baterías.
Motosierra a batería Einhell GE-LC 18 Li. Análisis, Opiniones y Comparativa – Top Monte
[…] La motosierra lleva una batería de litio. Te dejo aquí este artículo que explica de forma muy sencilla cómo funciona una batería de litio. […]
▷ Motosierra a batería Black and Decker GKC 1825 L20. Análisis, Opiniones y Comparativa
[…] La motosierra lleva una batería de litio. Te dejo aquí este artículo que explica de forma muy sencilla cómo funciona una batería de litio. […]
▷ Motosierra de batería Makita DUC355Z – Top Monte
[…] Te dejo aquí este artículo que explica de forma muy sencilla cómo funciona una batería de litio. […]
▷ Motosierra de batería Makita DUC252Z – Top Monte
[…] Te dejo aquí este artículo que explica de forma muy sencilla cómo funciona una batería de litio. […]
▷ Motosierra de batería Makita DUC254Z – Top Monte
[…] Te dejo aquí este artículo que explica de forma muy sencilla cómo funciona una batería de litio. […]
Héctor R. Sánchez
Es’ una pregunta: ¿Cuál es la diferencia entre un cargador de baterías de acido-plomo, co.o las de automóviles y un cargador de batería de litio? Su escrito es exelente. Gracias.
Reciclaje del litio: ¿pueden las baterías recicladas mejorar a las nuevas?
[…] recargarla, el proceso es similar, pero a la inversa. Los electrones y los iones de litio recorren el mismo camino en sentido inverso […]
Walter Gómez
Excelente información, Gracias.
Por favor revisar el siguiente párrafo «En 1991, la empresa Sony, en colaboración con Asahi Kasei, sacaron a la venta la primera batería ion litio comercial con ánodo de óxido de cobalto-litio y cátodo de coque. » de lo explicado en la primera parte, se entiende que el cátodo debe ser de óxido de cobalto – litio.
Revise la fuente e indica esto: «The battery was based on a petroleum coke–based anode material, LixCoO2 as the
cathode, and a water-free..»
Gracias nuevamente.
Herme Garcia Velasquez
Me parece bastante didactico, les agradezco tan valiosa informacion.
Funcionamiento de las baterías de litio y su riesgos por sobrecarga. Peligro de incendio – Extinhouse
[…] Fuentes:Déborah García Bello / Toyota […]
Para qué sirve el litio? Conoce más el mineral que revoluciona desde hace más de 5 años | Wonder Natos
[…] Antes de que se empezasen a fabricar baterías de litio ya se fantaseaba con la idea de poder hacer baterías de litio. La razón es que el litio es un metal que tiene tendencia a desprenderse de su electrón más externo. Al fin y al cabo, la electricidad es el tránsito de electrones, así que para producir electricidad necesitamos sustancias que tiendan a desprenderse de ellos. Pero este tema es más profundo así que conoce más presionando aquí. […]
Un supercondensador de iones de litio a partir de serrín
[…] ventajas presentes en los dos sistemas mencionados: puede acumular mucha energía (como en las baterías), puede funcionar a potencias altas y es capaz de soportar muchos ciclos de carga y descarga (como […]