Células madre para el tratamiento de la enfermedad inflamatoria intestinal
María Larumbe / GUK

La enfermedad inflamatoria intestinal (EII) es un concepto amplio que se usa para describir distintas patologías inmunomediadas, inflamatorias y crónicas, como la enfermedad de Crohn y la colitis ulcerosa, que presentan inflamación crónica del tracto digestivo. En la descripción que da la ACCU – Confederación Crohn y Colitis Ulcerosa – ambos trastornos alteran la capacidad del organismo para digerir los alimentos y absorber los nutrientes. Las personas que padecen esta enfermedad pueden presentar diarrea, sangre en las heces, cansancio, dolor abdominal, pérdida de apetito y peso o fiebre, entre otros síntomas.
En los últimos años, se está viviendo un aumento de la incidencia de la EII en la población a nivel mundial, sobre todo en las zonas urbanas de los países desarrollados. Más allá de las causas de componente genético, se sabe que algunos factores como el estrés que conlleva un estilo de vida frenético, las sustancias tóxicas presentes en el ambiente y la alimentación juegan un papel fundamental en la alteración de la flora intestinal. Esto provoca una respuesta inmune anómala que da lugar a la inflamación y sintomatología de la EII, dando como resultado que se reporten más casos de esta enfermedad.
Hasta la fecha no existe ningún tratamiento que cure esta enfermedad. Los fármacos disponibles en el mercado — como los aminosalicilatos, corticoesteroides e inmunomoduladores — tratan de disminuir la inflamación intestinal, evitar brotes de los síntomas y mantener la dolencia en remisión, pero no consiguen dar una respuesta definitiva.
Sin embargo, la evolución de las terapias avanzadas en farmacia y medicina abre la puerta al tratamiento efectivo de este tipo de patologías inflamatorias e inmunológicas. En concreto, en el grupo de investigación de NanoBiocel de la Facultad de Farmacia de la UPV/EHU — expertos en el desarrollo y encapsulación de medicamentos — llevan desde 2017 trabajando en un proyecto que tiene como objetivo desarrollar un medicamento efectivo para tratar esta enfermedad basado en células madre mesenquimales.
¿Por qué se han decantado por este tipo de células? Como explica Rosa Hernández — catedrática en Farmacia y responsable del proyecto dentro del grupo — “las células madre mesenquimales poseen una gran capacidad terapéutica a través de las sustancias que secretan entre ellas múltiples citoquinas y factores de crecimiento, y que pueden regular el funcionamiento de un sistema inmune alterado como sucede en el caso de pacientes con enfermedad de Crohn o colitis ulcerosa”.
Las terapias celulares no son desconocidas. Se llevan aplicando desde hace tiempo para el tratamiento de enfermedades como la leucemia. Es el caso del trasplante de médula ósea, que consiste en el reemplazo de células enfermas por células madre sanas.
Sin embargo, la aplicación de las terapias celulares en el tratamiento de la EII, presenta, según Hernández, ciertos problemas que son necesarios solventar para desarrollar un medicamento efectivo. “La célula es un organismo vivo que no se puede comprimir al igual que otros principios activos sintéticos como el ácido acetilsalicílico — principio activo de la Aspirina —. Por tanto, es necesario desarrollar nuevos sistemas que puedan encapsular esas células para implantarlas en el cuerpo y que sean capaces de secretar las sustancias terapéuticas durante largo tiempo”.
En este sentido, como afirma Hernández, no son los primeros en tratar de aplicar este tipo de terapias al servicio del tratamiento de la EII. “Partiendo de investigaciones previas en este ámbito, nuestro objetivo es desarrollar un sistema de administración que consiga potenciar y alargar los efectos positivos de las células madre, evitando además los problemas asociados a este tipo de terapias como son la rápida eliminación del organismo y la generación de trombos. Para ello, la correcta encapsulación de la célula es clave”.
Se trata de una investigación ambiciosa y colaborativa, financiada por el Ministerio de Ciencia e Innovación, que cuenta — además de con la participación del propio grupo de la UPV/EHU — con la colaboración de expertos en medicina, bioquímica, farmacia y biología de otras universidades como Harvard (EE.UU), la Universidad Católica de Lovaina (Bélgica) o centros médicos como el servicio de patología del Hospital Universitario de Álava.
Una factoría celular 24/7
Dentro de esta investigación multidisciplinar y colaborativa, el principal reto consiste en conseguir encapsular las células madre de forma efectiva y lograr que estén el suficiente tiempo en el organismo para mitigar la inflamación persistente y regenerar los tejidos dañados.
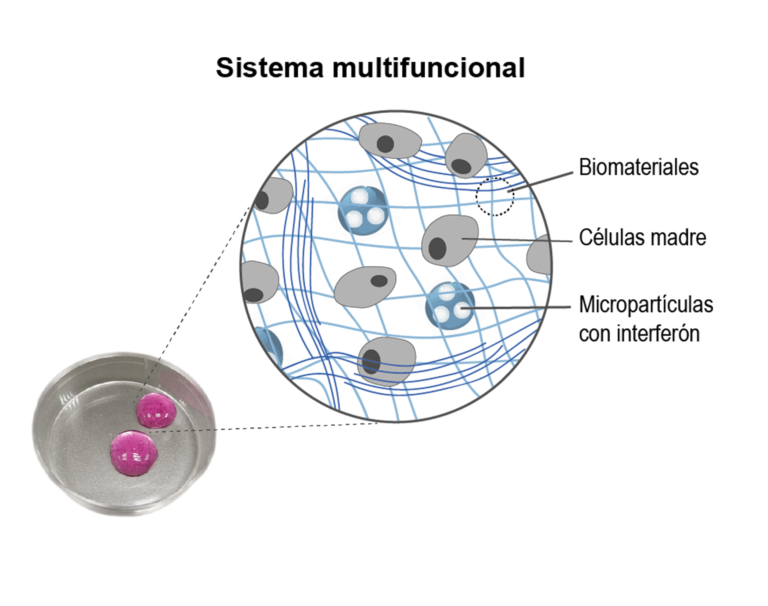
Para conseguir este objetivo, altamente complejo, han trabajado en el desarrollo de tres elementos fundamentales: un hidrogel para encapsular las células (soporte); las propias células madre (principio activo del medicamento) y el interferón gamma (sustancia activadora de las células).

En primer lugar, para resolver el problema de la encapsulación, han desarrollado un hidrogel en colaboración con la Universidad de Harvard, el cual funciona a modo de soporte y protege la célula. “Este hidrogel, compuesto por polímeros de origen natural, posee unas características biomiméticas que permiten que la célula se encuentre ‘como en casa’, proporcionando las condiciones adecuadas para que su supervivencia sea mayor”. Además, al introducir las células en este hidrogel, se tienen localizadas y se evita que puedan migrar a cualquier otra parte del organismo.
Por otro lado, el segundo componente que se ha utilizado para desarrollar este medicamento es el más importante: el propio principio activo, es decir, la célula. “En este caso, hemos optado por células madre mesenquimales de origen adiposo. A futuro, si todo va bien, al realizar la traslación clínica, el objetivo sería poder obtener las células de la grasa del propio paciente para que fuese un trasplante totalmente autólogo y que ocasione menos problemas desde el punto de vista de la respuesta inmune”. En este sentido, también se está investigando en el uso de otras células como las del folículo piloso, que tienen muy buenas propiedades inmuno-moduladoras y requieren de técnicas muy poco invasivas.
Por último, el tercer componente busca activar las células madre para que puedan secretar de manera continuada y prolongada las sustancias inmuno-moduladoras requeridas para tratar esta enfermedad. “Lo que hemos desarrollado son unas micropartículas que hemos unido a una sustancia ‘activadora’ llamada interferón gamma, que da las señales a la célula madre para que secrete las sustancias beneficiosas que disminuyan los síntomas de la EII.”
Este trabajo se ha realizado con el objetivo de crear un sistema multifuncional para su administración a nivel subcutáneo en el paciente, de forma que libere ininterrumpidamente estas sustancias terapéuticas, como si se tratara de una fábrica celular en constante funcionamiento.
Actualmente, la investigación se encuentra en fase preclínica. “Acabamos de realizar la primera prueba de concepto en ratones, siguiendo el modelo en estos animales para conseguir reproducir la enfermedad al igual que en los humanos”. Para llevar a cabo esta tarea, han contado con la colaboración del servicio de patología del Hospital Universitario de Álava, que diagnostica la enfermedad patológica en humanos y les han apoyado en la creación del modelo en ratones.
Tras realizar la autopsia a los ratones, “lo que se ha comprobado es que las células encapsuladas continúan vivas y siguen secretando las sustancias inmuno-moduladoras, lo que supone un paso hacia adelante en la investigación”, afirma Hernández. Sin embargo, hasta que no comprobemos los resultados histológicos no podremos determinar si este tratamiento ayuda a la regeneración tisular, es decir, de los tejidos del organismo”, afirma Hernández.
Tratamiento para otras enfermedades inmunológicas
La investigación, que comenzó hace cuatro años, tiene todavía un largo camino por delante. “Tendremos que acometer ajustes e ir controlando poco a poco el sistema, incorporando nuevos elementos que conseguirán mejorar el comportamiento de la célula en cuanto a las secreciones. Además de esto, probaremos otro tipo de células con propiedades inmuno-moduladoras, aunque las que estemos utilizando actualmente sean el gold standard.
A futuro, este tipo de terapias, tal y como explica Hernández, “se podrán introducir en el tratamiento de otras patologías inmunológicas en las que también aparecen inflamaciones o respuestas inmunes disfuncionales, como es el caso del lupus u otras enfermedades autoinmunes. Además, hoy en día también las estamos aplicando en terapias de regeneración de heridas crónicas con buenos resultados”.
En este sentido, las terapias celulares se están utilizando incluso en ensayos clínicos para la investigación de la COVID-19, tratando de frenar la respuesta inmune exacerbada en algunos pacientes con este virus.
Conseguir dar el salto del laboratorio al paciente y traducirlo en una mejora de su calidad de vida es el objetivo último de esta investigación. “Queremos aportar todo nuestro conocimiento en el desarrollo de fármacos para ayudar a conseguir unos tratamientos que sean más prolongados en el tiempo, más seguros y que mejoren la calidad de vida de los pacientes con estas patologías”.

Rosa Hernández es catedrática en Farmacia y Tecnología Farmacéutica y miembro del grupo de investigación NanoBioCel de la Universidad del País Vasco UPV / EHU.
Células madre para el tratamiento de la …
[…] María Larumbe / GUK La enfermedad inflamatoria intestinal (EII) es un concepto amplio que se usa para describir distintas patologías inmunomediadas, inflamatorias y crónicas, como la enfermedad de Crohn y la colitis ulcerosa, que presentan inflamación crónica del tracto digestivo. En la descripción que da la ACCU – Confederación Crohn y Colitis Ulcerosa – ambos … […]
Hesteetako gaixotasun inflamatorioa tratatzeko zelula amak – Zientzia Kaiera
[…] 1. irudia: Jatorri adiposoko zelula ama mesenkimalak (AT-MSCak), alginatozko hidrogeletan kapsulatuak. Tindaketa Live/dead tindaketa: zelula bideragarriak (berdea) eta ez-bideragarriak (gorria). (Argazkia: Cuaderno de Cultura Científica) […]