La base genética de la autoinmunidad: enfermedad celíaca y diabetes mellitus tipo I.
María Isabel Hernández
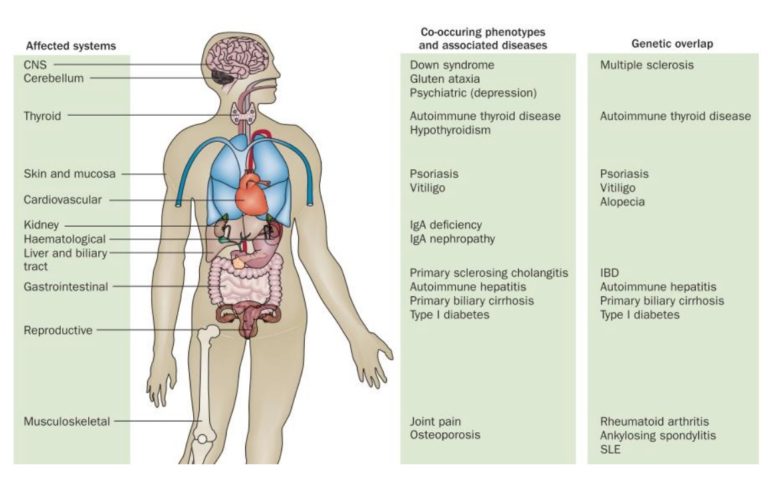
Las denominadas enfermedades autoinmunes, como lo son la enfermedad celíaca (EC) y la diabetes mellitus tipo 1 (DM1), se pueden clasificar en base a la extensión de los tejidos involucrados. Así se describen enfermedades específicas de órganos o tejidos, como lo sería la esclerosis múltiple, y enfermedades sistémicas, como la artritis reumatoide; pero en todos los casos, se requiere por parte de los linfocitos T y/o los linfocitos B del sistema inmunitario una pérdida de la tolerancia, es decir, la capacidad de diferenciar lo extraño de lo propio (Figura 1).
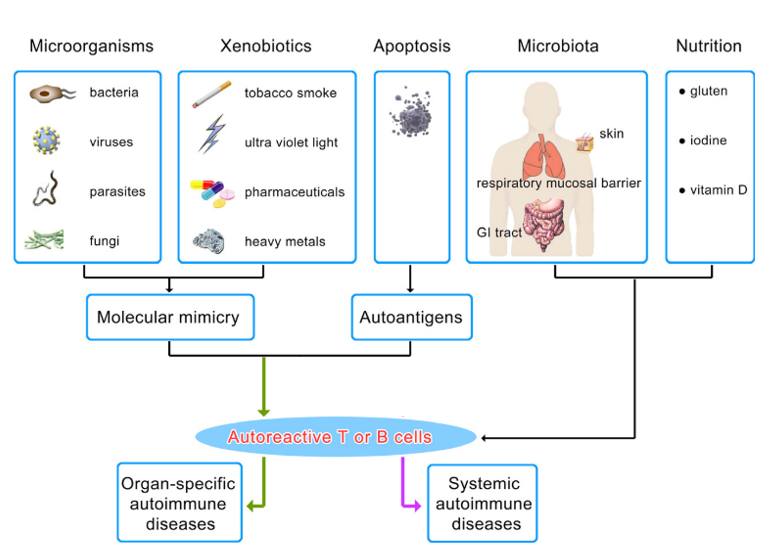
Las enfermedades autoinmunes sistémicas son el resultado del daño tisular inducido por la deposición de complejos inmunes con anticuerpos que se dirigen a moléculas que se expresan ubicuamente, en distintos tejidos, y tienen la capacidad de actuar como autoantígenos. Sin embargo, el hecho de que se produzcan enfermedades autoinmunes en distintos órganos y tejidos a la vez, afectando a las glándulas endocrinas u a otros tipos de tejidos, también puede deberse a que su origen se relaciona con mutaciones en los genes que intervienen en la respuesta inmunitaria innata y/o adaptativa, por lo que se producen fallos en el desarrollo de la respuesta inmunitaria allí donde sea necesaria (Ballarini & Lee-Kirsch, 2007; Wang, Wang & Gershwin, 2015; Theofilopoulos, Kono & Baccala, 2017; Caio et al., 2019).
En el caso de la EC y la DM1, además de compartir el hecho de que sean enfermedades autoinmunes que afectan al aparato digestivo, por lo cual la dieta puede ser un factor ambiental desencadenante, comparten varios locus que confieren predisposición genética (Figura 2). La prevalencia de la EC es entre 5-20 veces mayor en pacientes de DM1 que en la población normal.

Entre los genes analizados mediante estudios de asociación del genoma completo (GWAS) se han relacionado con las enfermedades autoinmunes los genes PTPN22, CTLA-4, IRF5 o BACH2, todos involucrados en la respuesta inmunitaria, junto con determinadas modificaciones epigenéticas. En cuanto a la EC y la DM1, se han relacionado con alteraciones en BACH2 que codifica un factor de transcripción que participa en la activación de los macrófagos tisulares, el desarrollo de células B y células T efectoras y reguladoras y la recombinación de cambio de tipo de inmunoglobulina, entre otras funciones. Por su parte, el haplotipo HLA-DQ2 se encuentra en aproximadamente el 90% de los pacientes de EC y el 55% de los pacientes de DM1, mientras que el haplotipo HLA-DQ8 se encuentra en aproximadamente el 10% de los pacientes de EC y el 70% de los pacientes de DM1. A través del complejo principal de histocompatibilidad (MHC) o también conocido como HLA (antígeno leucocitario humano), son presentadas las moléculas reconocidas como antígenos por las células presentadoras de antígeno (APC), macrófagos y células dendríticas, a las células T helper CD4+ (Todd, 2010; Lundin & Wijmenga, 2015; Kahaly & Hansen, 2016; Hagopian et al., 2017; Nunes-Silva et al., 2017; Caio et al., 2019).
La prevalencia tanto de la EC como de la DM1 han aumentado significativamente en los países occidentales durante los últimos años, al igual que el resto de las enfermedades autoinmunes no sólo digestivas afectando preferentemente a las mujeres y con una alta variabilidad fenotípica, morbilidad y mortalidad (Theofilopoulos, Kono & Baccala, 2017).A pesar de que haya factores genéticos comunes que predispongan la aparición de la EC y la DM1, el incremento en la prevalencia de ambas enfermedades en todo el mundo indica la importancia de los factores ambientales en su desarrollo, ya que los cambios genéticos que se pudieran producir para aumentarla necesitarían una altísima tasa de mutación. La homeostasis del intestino delgado se ha visto alterada en ambas, por lo que los factores ambientales que comprometan dicha homeostasis podrían ser factores desencadenantes. Una correcta función de barrera del intestino delgado, con uniones estrechas entre las células, se ve determinada por el tipo de bacterias que lo colonizan. Una alteración en el equilibrio de microrganismos que forman parte del microbioma intestinal, en cambios cualitativos y de funcionalidad, denominada disbiosis, se ha relacionado con enfermedades en sitios distantes del intestino, incluido un espectro de trastornos neurológicos, como ansiedad, estrés, migrañas y depresión, así como enfermedades neurodegenerativas y neuroinflamatorias (Wang, Wang & Gershwin, 2015; Theofilopoulos, Kono & Baccala, 2017). Por lo tanto, el hecho de que tanto la EC como la DM1 puedan aparecer en cualquier edad hace que sea importante estudiar qué factores ambientales pueden desencadenar su aparición, para prevenirla en pacientes donde se detecta la predisposición genética.
Referencias
Ballarini, A. et al. (2007) Genetic dissection of autoimmune polyendocrine syndrome type 2: Common origin of a spectrum of phenotypes. Annals of the New York Academy of Sciences 1110, 159–165.
Caio, G. et al (2019) Celiac disease: A comprehensive current review. BMC Medicine 17, 1–20.
Hagopian, W. et al (2017) Co-occurrence of type 1 diabetes and celiac disease autoimmunity. Pediatrics 140.
Kahaly, G.J. et al (2016) Type 1 diabetes associated autoimmunity. Autoimmunity Reviews 15, 644–648.
Lundin, K.E.A. et al (2015) Coeliac disease and autoimmune disease – Genetic overlap and screening. Nature Reviews Gastroenterology and Hepatology 12, 507–515.
Nunes-Silva, J.G. et al (2017) Impact of type 1 diabetes mellitus and celiac disease on nutrition and quality of life. Nutrition and Diabetes 7, 4–9.
Theophilopoulos, A.N. et al (2017) The multiple pathways to autoimmunity. Nature Immunology 18, 716–724.
Todd, J.A. (2010) Etiology of Type 1 Diabetes. Immunity 32, 457–467.
Wang, L. (2015) Human autoimmune diseases: A comprehensive update. Journal of Internal Medicine 278, 369–395.
Sobre la autora: María Isabel Hernández es graduada en biología y doctoranda en biología molecular y biomedicina en la UPV/EHU / Achucarro Basque Center for Neuroscience