La implantación del embrión en el útero, ex vivo y en directo
Las primeras etapas del desarrollo embrionario de los mamíferos son excepcionales en el mundo animal. La razón de esto se encuentra en otra característica única. El óvulo de los mamíferos placentados, humanos incluidos, carece de vitelo, es decir, de las sustancias nutritivas que necesita el embrión para su desarrollo. Por ello, necesita imperiosamente recibir cuanto antes nutrientes de la madre.
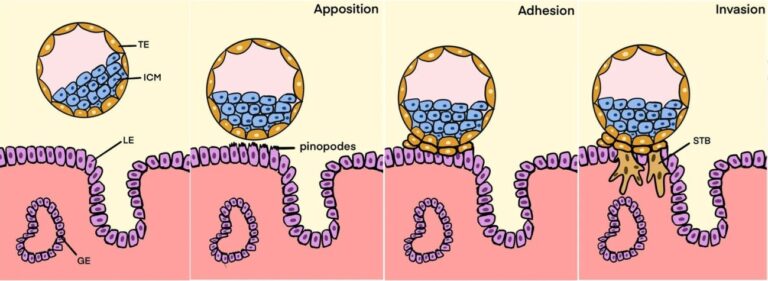
Cuando el óvulo es fecundado se divide varias veces y forma el blastocisto, compuesto por las células del futuro embrión y el trofoectodermo (figura 1). Para que el desarrollo pueda continuar, el blastocisto debe quedar implantado en el endometrio, la capa interna del útero. El trofoectodermo es el responsable de la implantación, se adhiere al epitelio uterino y comienza la invasión de los tejidos maternos. A consecuencia de la invasión se forman lagunas con sangre materna y se acondiciona el endometrio para organizar la futura placenta.
La implantación es un momento crítico para que la gestación progrese. En la reproducción asistida humana, un 50-60% de los blastocistos fracasan a la hora de implantarse en el útero. Sin embargo, si la implantación tiene lugar, la tasa de abortos desciende al 15%.
Lo que conocíamos de la implantación procede de los estudios hechos sobre tejido fijado y modelos transgénicos de ratón. De esta forma se ha podido identificar un número de genes implicados en el proceso. Sin embargo, no ha sido posible, hasta ahora, observar directamente el proceso de implantación. Estamos hablando de un blastocisto que tiene unas 200 células, mide menos de 0,2 mm y puede implantarse en cualquier punto del útero. No es algo que pueda verse fácilmente.
Esto ha cambiado gracias a la técnica desarrollada por un equipo de investigación de la universidad de Osaka (Japón), que ha conseguido implantar blastocistos de ratón ex vivo, es decir, en una placa de cultivo.
La técnica, desarrollada tras múltiples ensayos, consiste en obtener pequeños fragmentos de útero de ratonas preñadas y, por otro lado, blastocistos de otras ratonas. En los dos casos el tiempo de obtención se ajustó a 3,75 días tras el apareamiento con machos. Los blastocistos se colocaron sobre el endometrio de los fragmentos uterinos y se cubrieron con un polímero de silicona (polidimetilsiloxano) biocompatible y muy permeable a los gases. Después de ensayar diversos medios de cultivo se seleccionó uno que contenía dosis muy precisas de estradiol y progesterona, hormonas necesarias para la gestación.
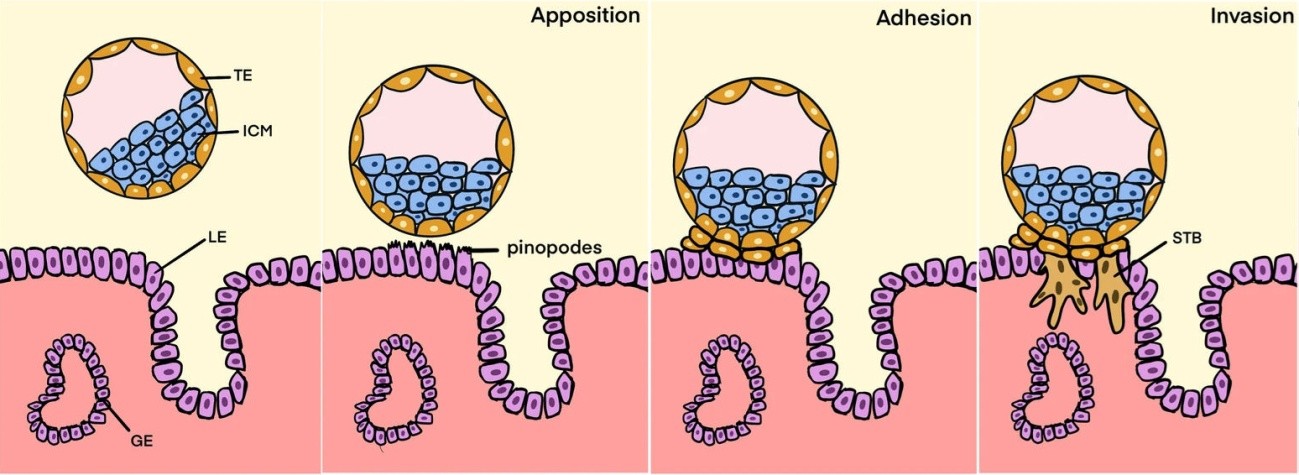
Más del 90% de los blastocistos así tratados se habían adherido al endometrio pasadas 24 h. A las 36 h, el trofoectodermo ya había roto el epitelio materno y comenzado la invasión de la pared uterina. Esta invasión era completa a las 48 h del comienzo del experimento. Al mismo tiempo, el embrión progresaba normalmente expresando los genes correspondientes a su estado de desarrollo (figura 2).
Desafortunadamente, este sistema no permitió alcanzar mucho más allá de un desarrollo correspondiente a los 5,5 días post coitum. Sin embargo, sí permitió hacer algunos experimentos para conocer mejor el proceso de implantación. El más llamativo fue la investigación del papel desempeñado por la ciclooxigenasa-2 (COX-2) en dicho proceso. Esta enzima cataliza la producción de prostaglandinas, moléculas implicadas en la inflamación y el dolor. Precisamente la aspirina, como otros antiinflamatorios no esteroideos (AINEs), ejerce su función analgésica y antiinflamatoria mediante la inhibición de la COX-2.
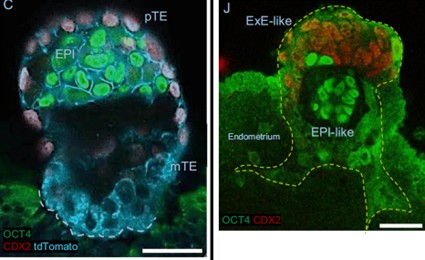
Desde hace tiempo se sabe que la COX-2 es necesaria para la implantación del blastocisto, y que es producida por células del endometrio, aunque se ignoraba su mecanismo de actuación. El grupo japonés confirmó en su modelo ex vivo que la inhibición de la COX-2 con celecoxib (un AINE) impedía la correcta implantación del blastocisto. El modelo permitió comparar la expresión génica de blastocistos en presencia de celecoxib y blastocistos control, que se implantaban normalmente. El resultado fue que un importante regulador de múltiples vías de señalización celular llamado AKT (o proteína kinasa B) no se activaba en el blastocisto si COX-2 no era operativa en el endometrio (figura 3).
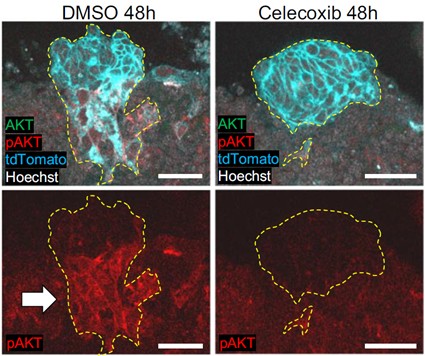
Esto se confirmó mediante inhibidores farmacológicos de AKT, que bloquearon también la implantación en el modelo ex vivo. Por otro lado, si se inducía la activación permanente de AKT, se soslayaba la necesidad de una COX-2 funcional en el endometrio. Por tanto, se demostró que las señales reguladas por la activación de AKT en el blastocisto son esenciales para su normal implantación.
El modelo ex vivo de implantación desarrollado por el grupo japonés ha demostrado ser una técnica del mayor interés para conocer los detalles de este momento crítico de la gestación. Los resultados que se deriven de su utilización pueden ser de mucha utilidad en el tratamiento de la infertilidad femenina.
Referencias
Hiraoka, T., Aikawa, S., Mashiko, D. et al. (2025). An ex vivo uterine system captures implantation, embryogenesis, and trophoblast invasion via maternal-embryonic signaling. Nat Commun. doi: 10.1038/s41467-025-60610-x.
Sobre el autor: Ramón Muñoz-Chápuli Oriol es Catedrático de Biología Animal (jubilado) de la Universidad de Málaga.