Bacterias que preparan el invierno midiendo el fotoperiodo
La medición del fotoperiodo, es decir, el número de horas de luz en un día determinado, permite anticipar condiciones ambientales cambiantes con las estaciones y regular así procesos fisiológicos como la migración, la floración, la hibernación o la reproducción estacional. Esto es muy conveniente cuando animales y plantas asisten al desfile de las estaciones a lo largo del año, pero ¿qué ocurre con bacterias que solo viven unas horas antes de dividirse? ¿Les puede interesar saber que se acerca el invierno?
La respuesta es que a algunas sí les interesa, y la historia de este reciente descubrimiento es apasionante. Primero tenemos que recordar qué es el reloj circadiano.
Los ritmos circadianos son cambios fisiológicos que siguen un ciclo aproximado de 24 horas. Por ejemplo, nuestro ciclo vigilia/sueño. El llamado jetlag se produce cuando este ritmo circadiano pierde la sincronía con el ciclo luz/oscuridad debido a un viaje. Después de unos cuantos días ambos ciclos vuelven a sincronizarse. Este y otros muchos cambios son controlados por el llamado reloj circadiano, descubierto en los años setenta y bien caracterizado a nivel molecular.
Resulta sorprendente, pero procariotas como la cianobacteria fotosintética Synechococcus (Figura 1), que viven unas horas antes de dividirse, también tienen un reloj circadiano. Sus mecanismos fueron descubiertos por el grupo de Carl H. Johnson en la Universidad Vanderbilt. Solo tres genes, KaiA, B y C, interactuando de forma compleja (explicado en la Figura 2), permiten que los procesos fisiológicos de Synechococcus se ajusten a un ciclo aproximado de 24 horas, a pesar de que en ese periodo habrá experimentado cuatro ciclos de división.
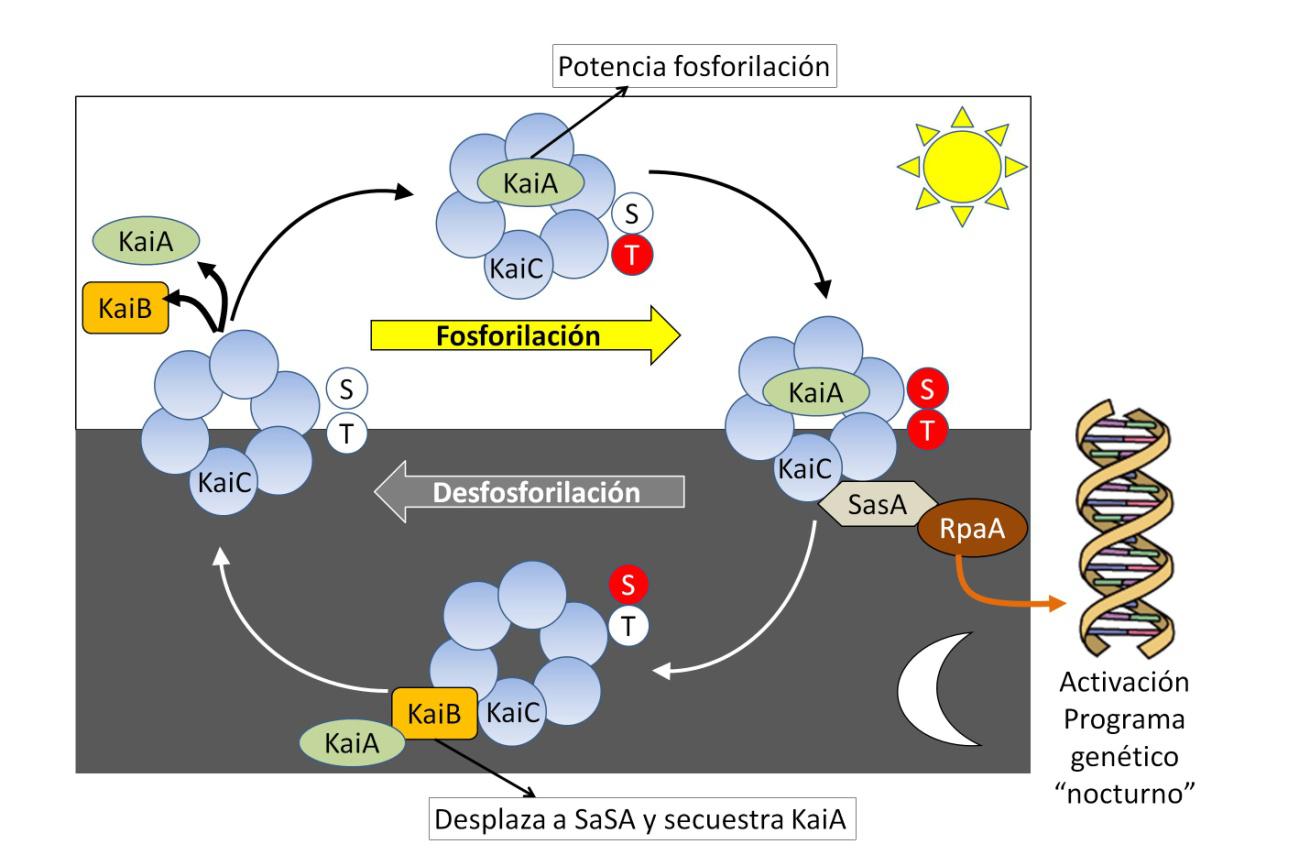
Buena parte de los genes de Synechococcus siguen un ritmo circadiano. Durante el día (temperatura alta, luz ultravioleta, fotosíntesis activa) se activan mecanismos de respuesta al calor, al estrés oxidativo y a los daños en el ADN. Cuando cae la noche cesa la fotosíntesis y aumenta el metabolismo de carbohidratos para suministrar energía. A diferencia de otros organismos, la sincronización del reloj no se produce captando la luz mediante pigmentos fotorreceptores, sino en función del estado de oxidación-reducción que se establece durante la fotosíntesis diurna.
Una estudiante de Johnson, María Luisa Jabbur, sugirió a su jefe la posibilidad de que el reloj circadiano de Synechococcus pudiese ser utilizado también para anticipar cambios estacionales y prepararse para el frío. Esta idea fue recibida con muchísimo escepticismo. Si ya era difícil imaginar que una bacteria se ajustara a un ritmo diario cuatro veces más largo que su ciclo vital, pensar que podría hacer previsiones a un plazo de meses resultaba inverosímil. No obstante, Luisa recibió autorización para investigarlo. Tuvo éxito y sus resultados acaban de ser publicados en la revista Science.
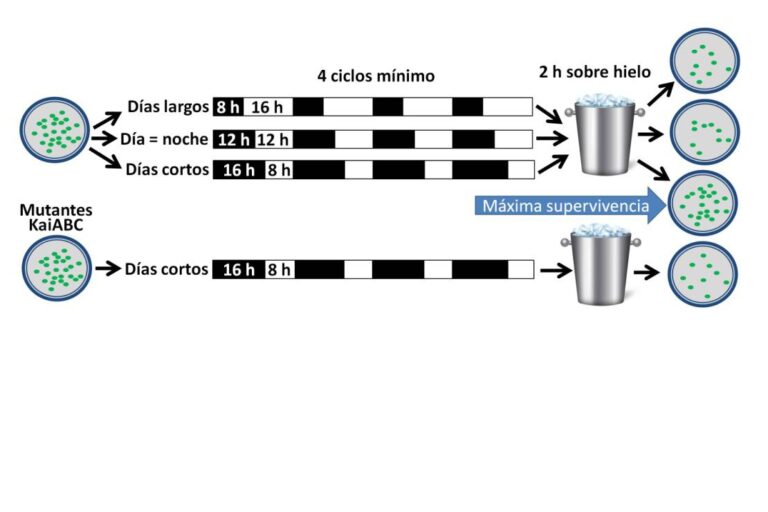
Los experimentos de Mª Luisa Jabbur consistieron en someter a las bacterias a tres fotoperiodos, día corto (8 horas de luz, 16 de oscuridad), día equinoccial (12 horas de luz y oscuridad) y día largo (16 horas de luz, 8 de oscuridad) (Figura 3). Después de varios días, las bacterias fueron mantenidas durante dos horas en un medio helado. Sorprendentemente, la tasa de supervivencia de las que habían experimentado los días cortos fue 2-3 veces superior al resto. El equipo constató que eran necesarios al menos cuatro ciclos de alternancia luz/oscuridad para obtener esos resultados, y la supervivencia óptima se conseguía después de 6-8 ciclos.
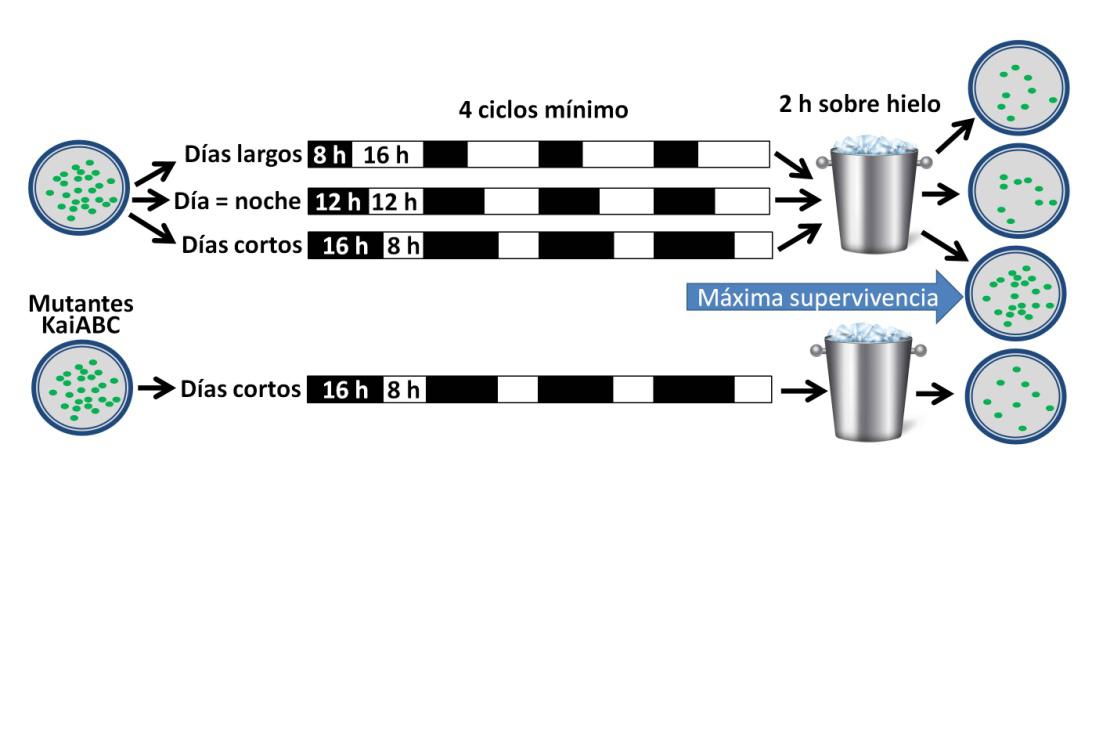
Otro experimento importante consistió en utilizar bacterias mutantes para los genes KaiA, B y C. De esta forma se comprobó que cuando las bacterias no eran capaces de establecer el ritmo circadiano, tampoco se adaptaban a las temperaturas bajas a pesar de haber experimentado fotoperiodos cortos.
El mecanismo de adaptación a las bajas temperaturas pasa por un aumento de la fluidez de las membranas celulares. Esta fluidez depende del grado de saturación de los lípidos que las componen. Como bien sabemos, el aceite de oliva es fluido a temperatura ambiente, la mantequilla lo es mucho menos, y esto se debe a las grasas insaturadas del aceite. El fotoperiodo corto en Synechococcus provoca la activación de un programa genético que incluye la síntesis de lípidos insaturados y su incorporación a las membranas celulares. Un estudio del transcriptoma de Synechococcus mostró que 708 genes (la cuarta parte del total) cambian sus niveles de expresión al reducirse el fotoperiodo. Sin embargo, en los mutantes KaiABC, incapaces de establecer un ritmo circadiano, solo 384 genes modifican sus niveles de expresión al acortarse los días. Esto muestra que un buen número de genes responde específicamente a la disminución del ritmo circadiano, sincronizado a través de la fotosíntesis como dijimos antes.
La investigación también mostró que el cultivo a bajas temperaturas (20 °C) provoca cambios adaptativos en la fluidez de las membranas, pero dichos cambios son mucho más pronunciados si van acompañados por un acortamiento del fotoperiodo. Es decir, la medición del fotoperiodo realmente anticipa la estación fría que se aproxima y prepara a las bacterias para enfrentarla. Una cuestión que deberá aclararse en el futuro es cómo Synechococcus transmite a los descendientes la previsión de que se acerca el invierno.
Referencia
Jabbur, M.L., Bratton, B.P., Johnson, C.H. (2024) Bacteria can anticipate the seasons: Photoperiodism in cyanobacteria. Science. doi: 10.1126/science.ado8588.
Sobre el autor: Ramón Muñoz-Chápuli Oriol es Catedrático de Biología Animal (jubilado) de la Universidad de Málaga