La metástasis ósea es una de las derivaciones más temibles en la evolución de un cáncer. Entre las complicaciones acarreadas por estas metástasis se encuentra la anemia, una condición que deteriora aún más el estado de salud del paciente. Hasta ahora, se pensaba que la anemia era debida a la colonización de la médula ósea por parte del tumor. En este lugar se produce la hematopoyesis, es decir, la producción de células sanguíneas. Se suponía que la invasión tumoral interfería con la generación de eritrocitos (glóbulos rojos). Recordemos que los eritrocitos deben ser continuamente producidos para reemplazar a los que son destruidos tras una vida media de unos cuatro meses, y en caso contrario se produce una anemia.
Una investigación que se acaba de publicar en la revista Cell por un grupo de científicos estadounidenses proporciona un nuevo escenario sobre las causas de la anemia asociada a la metástasis ósea. Para entender esta nueva visión debemos explicar primero el proceso de producción de eritrocitos.
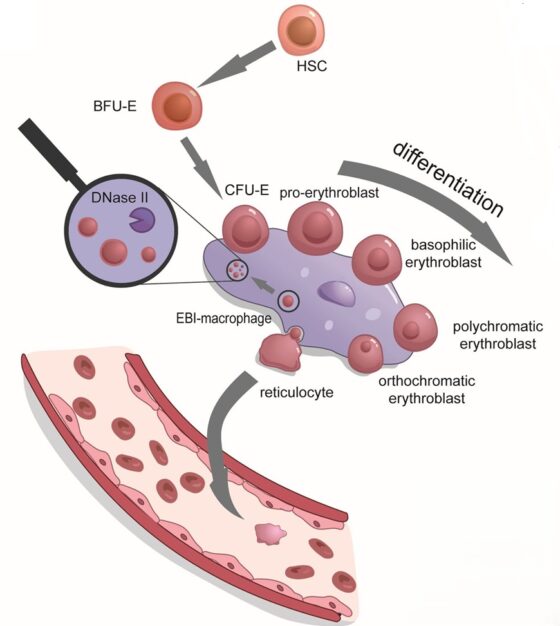
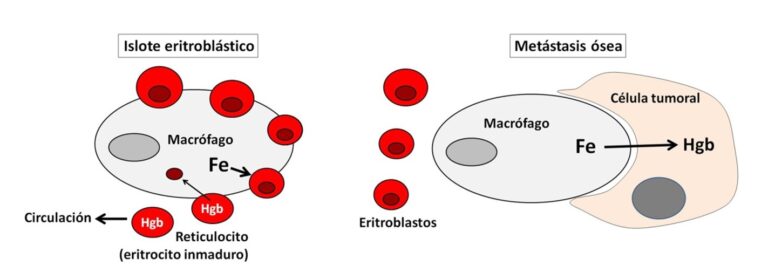
Los eritrocitos derivan de las células madre hematopoyéticas a partir de un proceso finamente regulado a nivel molecular (Figura 1). En primer lugar, se diferencian precursores denominados unidades formadoras de cúmulos eritroides (BFU-E) y unidades formadoras de colonias eritroides (CFU-E). A partir de este momento interviene un tipo especial de macrófagos[1] que se encargarán de promover la eritropoyesis, es decir, la diferenciación de los eritroblastos (precursores de los eritrocitos). Estos macrófagos también fagocitan sus núcleos celulares, ya que los eritrocitos de los mamíferos carecen de núcleo. Otra de las funciones esenciales de los macrófagos es proporcionar hierro a los eritroblastos, de forma que puedan sintetizar la hemoglobina transportadora de oxígeno. Completado el proceso, los eritrocitos se incorporan a la circulación sanguínea. Los macrófagos, junto con los eritroblastos en diferentes momentos de su diferenciación, forman los llamados islotes eritroblásticos (Figura 2).
Los autores del artículo de Cell utilizaron una compleja técnica de marcaje celular. Células tumorales de ratón fueron modificadas para producir dos moléculas fluorescentes, una verde, que permanece dentro de la célula, y otra roja capaz de atravesar la membrana celular e incorporarse a células muy próximas. Estas células, inyectadas en ratones, producen metástasis óseas. Su estudio permitió observar que macrófagos con las mismas características que los asociados a los islotes eritroblásticos se marcaban de rojo, indicando que habían sido atraídos hacia las células tumorales. Otros experimentos mostraron que estos macrófagos proporcionaban hierro a las células del tumor, descuidando su función normal de promoción de la eritropoyesis (Figura 3). No fue una sorpresa que los ratones desarrollaran una fuerte anemia.

¿Para qué quiere hierro el tumor? La médula ósea es uno de los ambientes más hipóxicos (pobres en oxígeno) del organismo. Las células tumorales utilizan hierro para sintetizar hemoglobina y resistir así la hipoxia. Un experimento adicional mostró que cuando se eliminaban específicamente los macrófagos asociados a los tumores, se reducía tanto el crecimiento de las metástasis como la anemia. Esto demostraba que el “robo” de hierro era fundamental para la progresión tumoral en el hueso.
¿Cómo logran las células tumorales que los macrófagos abandonen sus funciones y se pongan a su servicio? Los investigadores mostraron que el tumor produce citoquinas, moléculas que regulan las interacciones entre las células del sistema inmune. Los macrófagos responden a esas señales y abandonan los islotes eritroblásticos.
Nuestra última pregunta, y la más importante: ¿Este descubrimiento proporciona oportunidades para el tratamiento de las metástasis óseas en humanos? Hay que tener mucha prudencia, pero es posible que sea así. En la investigación mencionada se estudiaron muestras humanas de metástasis óseas derivadas de diferentes tipos de cáncer y en todos los casos se encontraron las mismas asociaciones entre macrófagos y células tumorales que, además, se cargaban de hierro. Si se pudiera bloquear el acceso del tumor al hierro y/o que los macrófagos mantuvieran su función eritropoyética sin responder a las señales del tumor, el resultado debería ser una disminución tanto de la anemia como del crecimiento tumoral. Es de esperar que a partir de ahora se emprendan investigaciones en este sentido.
Referencias
Han, Y., Sarka,r, H., Xu, Z. et al. (2025). Tumors hijack macrophages for iron supply to promote bone metastasis and anemia. Cell. https://doi.org/10.1016/j.cell.2025.08.013.
Nota:
[1] Los macrófagos son un grupo de leucocitos con múltiples funciones en el sistema inmune (fagocitosis, inflamación, presentación de antígenos) y también en el mantenimiento y reparación de los tejidos.
Sobre el autor: Ramón Muñoz-Chápuli Oriol es Catedrático de Biología Animal (jubilado) de la Universidad de Málaga.