En el siglo XVIII (e incluso antes) se pensaba que la combinación química estaba gobernada por las leyes de la “afinidad química” tal y como se medía (entre otras formas) por la energía y las proporciones en la que ácidos y bases se combinaban para formar sales. Cuando comenzaron a desarrollarse la teoría atómica y la electroquímica casi simultáneamente a comienzos del siglo XIX, la mayor parte de los teóricos eran de la opinión de que los átomos que forman los compuestos químicos se mantenían juntos por las fuerzas electrostáticas polares.
La electronegatividad o electropositividad de una sustancia podía medirse por su comportamiento en una célula electroquímica; la intensidad y el signo variaban con la sustancia y era una característica primaria de cada elemento. Desarrollada entre 1810 y mediados de los años veinte por Jacob Berzelius, la teoría del dualismo electroquímico funcionaba bien para los compuestos inorgánicos, pero ya en los años treinta se encontró con enormes dificultades en la química orgánica.
Ciertos elementos parecían ser capaces de sustituir a otros en los compuestos independientemente de su carácter electroquímico. Un estudio de compuestos inorgánicos y organometálicos llevado a cabo por Edward Frankland en 1852 llevó a éste a la conclusión de que los átomos de nitrógeno, fósforo, antimonio y arsénico parecían combinarse siempre con tres o con cinco átomos, sin que importase la electroquímica. A finales de la década, un amigo de Frankland, Hermann Kolbe, comenzó a aplicar la idea a compuestos orgánicos.
Antes incluso que apareciese el artículo de Frankland de 1852, Alexander Williamson ya había señalado la naturaleza “bibásica” de ciertos radicales orgánicos y pronto ampliaría el concepto para incluir al oxígeno. Siguiendo la idea de Williamson, Charles-Adolphe Wurtz, William Odling y August Kekulé estudiaron su aplicación en la química orgánica para el hidrógeno, el oxígeno, el azufre, el nitrógeno y, en última instancia, para el carbono.
Kekulé resumió el estado de la cuestión en dos artículos publicados en 1857 y 1858. Afirmaba que los átomos de cada elemento parecían tener cierta capacidad fija para combinarse con los átomos del mismo u otros elementos; llamó a estos componentes de la capacidad de combinación “unidades de afinidad”. Los átomos de hidrógeno y cloro tenían cada uno una de estas unidades; el oxígeno y el azufre, dos; el nitrógeno, el fósforo y el antimonio, tres; y el carbono, cuatro. Casi diez años después este concepto pasó a llamarse “valencia”.
Kekulé escribió que la fórmula del agua, H2O, significaba que dos átomos de hidrógeno monovalentes se combinaban con un átomo de oxígeno divalente; la del etano, H3CCH3, se mantenía unida porque cada grupo metilo (CH3) tenía una unidad de valencia del carbono tetravalente sin usar y se satisfacían mutuamente al “engancharse” juntas; y así con el resto de fórmulas. Esta teoría de la valencia atómica encontró pronto muchas pruebas a favor y en poco tiempo la mayoría de los químicos importantes la apoyaron.
Kekulé usó conceptos de valencia para desarrollar una teoría de la “estructura química”. Los átomos de carbono, escribió, podían usar algunas de sus valencias para unirse entre sí y crear “cadenas” de carbono, formando el “esqueleto” de una molécula. Siguiendo las reglas de valencia los átomos de otros elementos como el hidrógeno, el oxígeno y el nitrógeno podían incorporarse a este esqueleto para formar las moléculas de (potencialmente) todos los compuestos conocidos entonces.
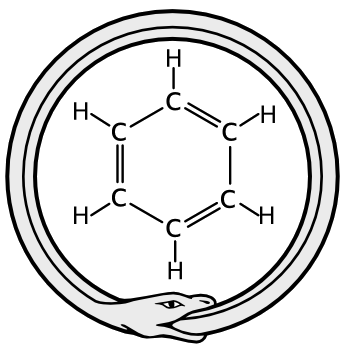
La formulación de ideas auxiliares, como la existencia de enlaces múltiples (el etileno como H2C=CH2, el formaldehído como H2C=O, etc.) demostró que la teoría estructural podía explicar un amplio abanico de fórmulas orgánicas. En 1865 Kekulé demostró cómo la tetravalencia del carbono podía usarse para derivar una prometedora fórmula candidata para la crucial molécula del benceno, C6H6, el prototipo de todos los llamados compuestos aromáticos. Kekulé sugería un anillo cerrado de seis átomos de carbono con enlaces alternos simples y dobles y con un átomo de hidrógeno enlazado a cada carbono. Esta fórmula fue aceptada rápidamente.
A pesar de la importancia de sus aportaciones a su desarrollo en sus inicios, Frankland y Kolbe rechazaron las implicaciones de la teoría de la valencia y estructura, si bien Frankland terminaría aceptándola poco antes de la publicación de la fórmula del benceno. Un problema que encontraban era la cantidad de hipótesis auxiliares necesarias para hacer que la teoría funcionase bien. Además, no estaba claro que la valencia fuese una propiedad constante y característica de cada elemento o si variaba en función del entorno químico, como Frankland había sugerido inicialmente. Las disputas sobre la constancia de las valencias continuaron durante décadas y no terminaron de dirimirse hasta el desarrollo de la teoría electrónica del enlace ya entrado el siglo XX.
Sobre el autor: César Tomé López es divulgador científico y editor de Mapping Ignorance
Esta anotación es una participación de Experientia docet en el XXXVIII Carnaval de la Química cuyo blog anfitrión es Pero eso es otra historia…
De la valencia y el enlace químico (I)
[…] De la valencia y el enlace químico (I) […]
De la valencia y el enlace químico (I)
[…] Ver noticia original Fecha de alta: 05-08-2014lamazmorradelandroide.com, De la valencia y el enlace químico (I)Valoración: 3 sobre 5 <<>> […]
De la valencia y el enlace químico (I) |…
[…] En el siglo XVIII (e incluso antes) se pensaba que la combinación química estaba gobernada por las leyes de la “afinidad química” tal y como se medía (entre otras formas) por la energía y las proporciones en la que ácidos y bases se combinaban para formar sales. Cuando comenzaron a desarrollarse la teoría atómica y la electroquímica casi simultáneamente a comienzos del siglo XIX, la mayor parte de los teóricos eran de la opinión de que los átomos que forman los compuestos químicos se mantenían juntos por las fuerzas electrostáticas polares. […]
De la valencia y el enlace químico (I) |…
[…] En el siglo XVIII (e incluso antes) se pensaba que la combinación química estaba gobernada por las leyes de la “afinidad química” tal y como se medía (entre otras formas) por la energía y las proporciones en la que ácidos y bases se combinaban […]