Para algunos químicos la teoría de la valencia, y la estructural basada en ella, resultaban poco elegantes. Las conexiones por valencia entre átomos parecían referirse a la existencia de “enganches” de algún tipo, o de alguna especie de “pegamento”, en los propios átomos más que a una fuerza natural isótropa con la majestuosidad de la gravedad o la efectividad de la eléctrica.
Frankland llegó a referirse a estas conexiones de valencia como “enlaces” pero no elaboró la descripción de los mismos. Por otra parte la gravitación parecía excluirse como causa de la valencia habida cuenta de la complejidad y estabilidad de los compuestos químicos; la atracción eléctrica quedaba excluida desde el momento en que los átomos de un mismo elemento podían enlazarse entre sí. Por lo tanto aceptar la idea de valencia parecía requerir renunciar a la posibilidad de comprender la afinidad química como originada por una fuerza macroscópica conocida. Se estaba ante un concepto singularmente químico y no descrito por la física de finales del XIX.
A pesar de todo la teoría de la valencia iba logrando éxitos de la mano de nuevos desarrollos teóricos y experimentales. Las anomalías no explicadas por el modelo de Kekulé del benceno llevaron a que Lothar Meyer, Henry Edward Armstrong y F.K. Johannes Thiele empezasen a hablar de enlaces de valencia parciales o enlaces centrípetos. En 1874 J.H. van’t Hoff y Joseph le Bel comenzaron a explorar los enlaces de valencia en tres dimensiones. En la última década del siglo Alfred Werner usaba una teoría de la valencia modificada, en la que incorporaba la nueva teoría iónica de Svante Arrhenius, para representar con éxito la composición molecular de ciertas sustancias inorgánicas llamadas compuestos de coordinación.
Cuando J.J. Thomson demostró en 1897 la existencia del electrón, varios físicos y químicos no tardaron en considerar la posibilidad de que esta partícula ofreciese alguna forma nueva de entender la valencia. En 1904 el propio Thomson desarrollaba una teoría atómica en la que los electrones podían circular en capas externas del átomo. Ese mismo año Richard Abegg formulaba una regla mucho más explícita, la “regla del ocho”, que se correspondía con las regularidades periódicas observadas en las valencias de los átomos.
Durante y justo después de la Primera Guerra Mundial, Walther Kossel y Gilbert N. Lewis comenzaron a desarrollar independientemente teorías electrónicas del enlace químico, un concepto que amplió con éxito poco después Irving Langmuir. Los átomos neutros tenían tantos electrones fuera del núcleo como protones en él. En la nueva teoría, en los periodos segundo y tercero de la tabla periódica, que tienen cada uno ocho elementos, el de mayor número atómico de cada periodo tiene un “octeto” de electrones, estable y que no interviene en enlaces (gases nobles). Más allá de las capas con octetos completos pueden existir capas con menos de ocho electrones, los “electrones de valencia”, que pueden compartirse con átomos adyacentes para formar enlaces químicos. Así, el aluminio, por ejemplo, que tiene número atómico 13, está once lugares más allá del helio, el primer gas noble, o tres más allá del primer octeto completo (el del neón), por lo que su valencia es 3 al tener tres electrones libres en la capa más externa para compartir.
Langmuir distinguía además entre enlace “iónico”, donde existía una “transferencia” de un electrón de un átomo electropositivo a un átomo electronegativo, de lo que él llamaba “enlace covalente”, en el que dos electrones, uno de cada uno de los átomos que formaban el enlace, se compartían más o menos igualitariamente. En el primer caso era la atracción electrostática la que mantenía los átomos unidos; en el segundo caso la “electricidad” intervenía de una forma que no se comprendió hasta el desarrollo de la mecánica cuántica.
Mientras tanto Niels Bohr y sus colaboradores habían desasarrolado la teoría de la estructura electrónica de los átomos, usando los patrones de la tabla periódica, y que explicaba los espectros atómicos haciendo uso de principios no continuos (cuánticos). El trabajo paralelo de Louis de Broglie y Erwin Schrödinger comenzó a proporcionar explicaciones teóricas de la naturaleza direccional tridimensional de los enlaces químicos.
A finales de los años veinte y comienzos de los treinta del siglo XX, Walter Heitler, Fritz London, John Slater, Linus Pauling y otros desarrollaron la “teoría del enlace de valencia” como una aplicación de la nueva mecánica cuántica desarrollada paralelamente por Erwin Schrödinger y Werner Heisenberg. Esto implicaba construir funciones de onda para representar los pares de electrones de un enlace covalente al estilo de Lewis. Aproximadamente al mismo tiempo Robert Mullikan desarrolló una técnica mecanocuántica alternativa para comprender el enlace químico basada en los que él llamó “orbitales moleculares”.
Erich Hückel aplicó ambos métodos, enlace de valencia y orbital molecular, al problema de los compuestos aromáticos y encontró que el método de Mullikan era mejor. El método del orbital molecular parecía aportar un modelo más limpio y satisfactorio y, después de la Segunda Guerra Mundial, desplazó al modelo de enlace de valencia a pesar de la resistencia opuesta por Pauling.
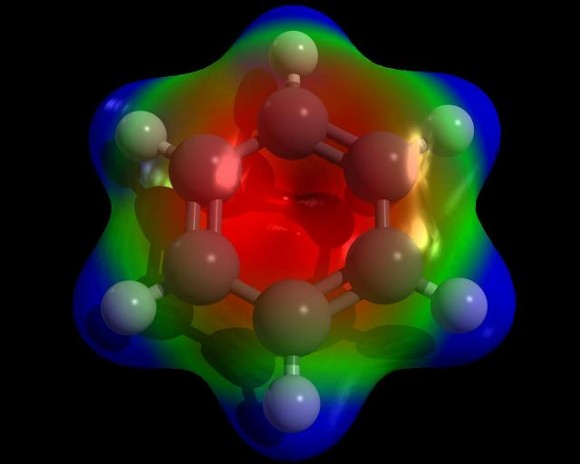
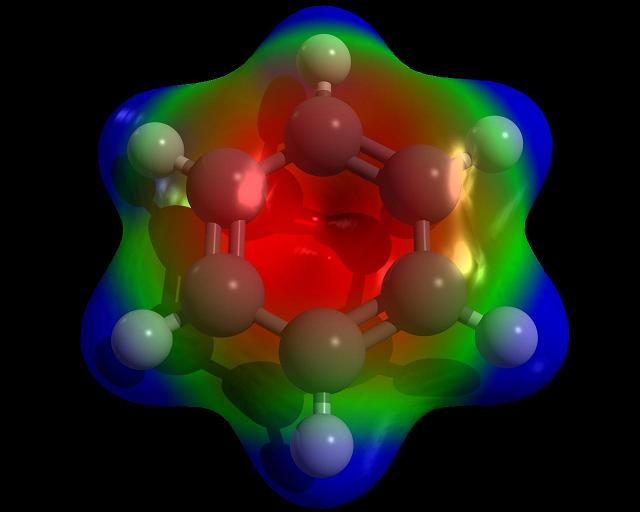
Tanto el enlace de valencia como el orbital molecular han llevado al concepto de “resonancia”: los enlaces entre los átomos de carbono del anillo bencénico no podrían considerarse ni enlaces simples ni dobles, sino más bien unos “híbridos resonantes” a mitad de camino entre los dos estados. La resonancia ha explicado con éxito la curiosa pasividad de los dobles enlaces de los compuestos aromáticos frente a la adición y ha ampliado el concepto de “aromaticidad” a compuestos no bencénicos.
Con todo, a los químicos aún les quedan muchos modelos teóricos que desarrollar para explicar el comportamiento químico observado de las moléculas.
Sobre el autor: César Tomé López es divulgador científico y editor de Mapping Ignorance
Esta anotación es una participación de Experientia docet en el XXXVIII Carnaval de la Química cuyo blog anfitrión es Pero eso es otra historia…
De la valencia y el enlace químico (y II…
[…] Para algunos químicos la teoría de la valencia, y la estructural basada en ella, resultaban poco elegantes. Las conexiones por valencia entre átomos parecían referirse a la existencia de “enganches” de algún tipo, o de alguna […]
Lo Mejor de la Semana (10-16 de agosto) | Hablando de Ciencia | Artículos
[…] De la valencia y el enlace químico. […]
De la valencia y el enlace químico (y II…
[…] Para algunos químicos la teoría de la valencia, y la estructural basada en ella, resultaban poco elegantes. […]
Fritz London: cuando la química se hizo cuántica pero no se lo contaron a Pauling — Cuaderno de Cultura Científica
[…] más tarde el propio Pauling describiría el acontecimiento como “la mayor contribución a la concepción química de valencia” desde la introducción por Lewis de la idea de par compartido en […]
Un anillo aromático de seis átomos de nitrógeno — Cuaderno de Cultura Científica
[…] De la valencia y el enlace químico (y II) […]