Juan Gefaell
Uno de los fenómenos biológicos más extendidos en la naturaleza es el del polimorfismo de color, esto es, la coexistencia de individuos de más de un color en las poblaciones naturales de las distintas especies. Consideremos los siguientes lagartos, todos ellos de la especie Podarcis erhardii:

Tal y como se observa en la Figura 1, los distintos individuos de esta especie pueden mostrar tres colores bien diferenciados en la zona de la garganta.
A pesar de su extensión a lo largo y ancho del reino animal (y vegetal), las causas evolutivas del polimorfismo de color todavía no se conocen con exactitud.
Es más, desde cierto punto de vista, su existencia misma es paradójica, puesto que los principales mecanismos que los biólogos emplean para dar cuenta de la evolución de las especies predicen que las poblaciones, más que polimórficas, deberían tender en realidad hacia el monomorfismo, esto es, a la prevalencia de individuos de un único color. Así, los modelos clásicos de selección natural y deriva genética establecen que la variabilidad genética (en última instancia responsable de la variación fenotípica) mengua a medida que estos dos mecanismos operan sobre las poblaciones de organismos.
Por este motivo, el polimorfismo de color es un tema de investigación que atrae especialmente a los biólogos evolutivos.
La selección negativa dependiente de las frecuencias (NFDS)
Uno de los mecanismos evolutivos que se han formulado para explicar el paradójico origen del polimorfismo de color es la selección negativa dependiente de las frecuencias (NFDS por sus siglas en inglés). A pesar de su enrevesado nombre, la idea clave de la NFDS es sencilla: cuanto más frecuente es un fenotipo en una población, menor es su eficacia biológica o capacidad para reproducirse. O lo que es lo mismo: cuanto más raro es un fenotipo, mayor es su eficacia. Esto queda claro con el siguiente gráfico:

La hipótesis de la NFDS ya ha mostrado su capacidad para explicar el polimorfismo de color en algunas especies. Quizás el ejemplo más clásico en este sentido sea el de los caracoles del género Cepaea, estudiados por Bryan Clarke en los años 60 del siglo pasado. En sus investigaciones, Clarke mostró que la NFDS era en gran parte responsable del polimorfismo de color presente en dichas especies.

Resulta que los depredadores de Cepaea, principalmente aves, tienden a formarse imágenes de los colores más habituales en estas especies, de manera tal que, a la hora de depredar, buscan preferentemente a aquellos individuos que coinciden con dichos colores. De este modo, aquellos ejemplares que se alejan significativamente de los colores más frecuentes tienden a dejar más descendencia, pues son ignorados por los depredadores, convirtiéndose así con el paso de las generaciones en el fenotipo más frecuente de la población.
Una vez esto sucede, se invierte la ecuación: las aves depredadoras pasan a formarse imágenes de este nuevo color más frecuente, por lo que lo cazan en mayor medida que a aquellos colores se presentan en menor frecuencia (que en el pasado eran los predominantes). Esto, a la larga, favorece que las poblaciones mantengan el polimorfismo de color.
El género Littorina
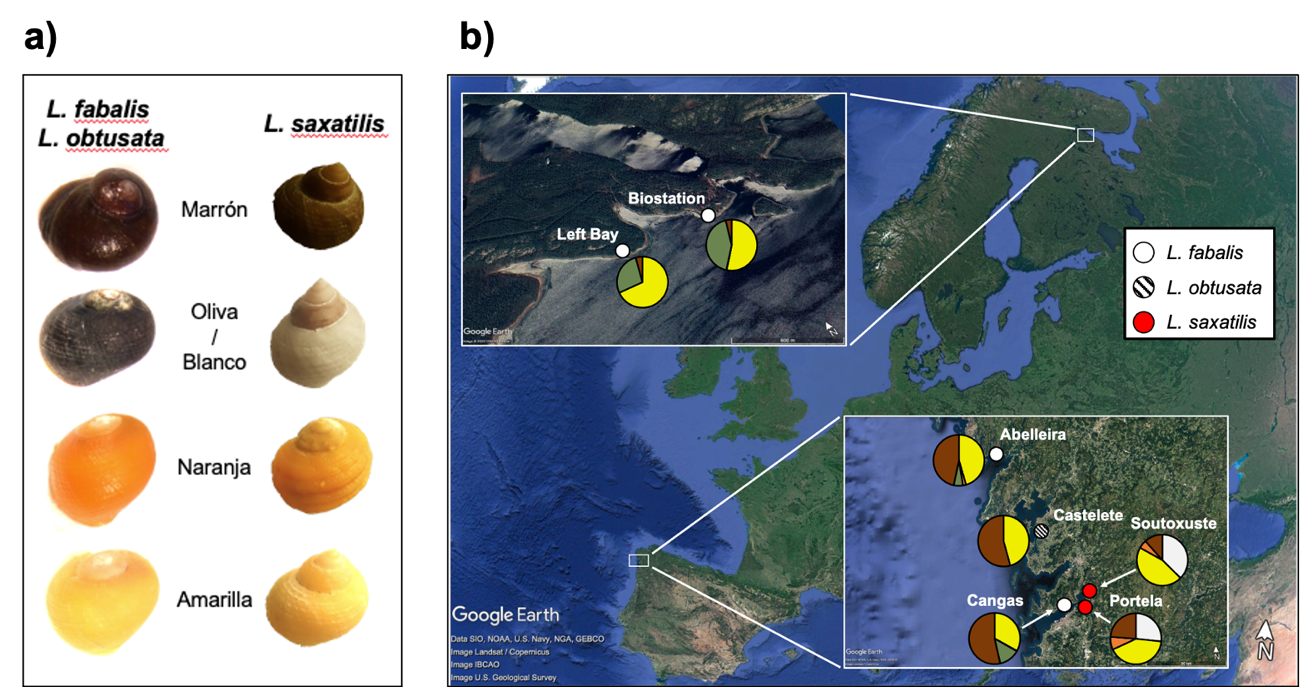
Otro grupo de caracoles (en este caso marinos) en el cual el polimorfismo de color está también extendido es el género Littorina. Así, las diversas especies de este género a menudo muestran poblaciones diversas en lo que a su color de concha se refiere, tal y como se puede apreciar, por ejemplo, en la siguiente imagen de L. saxatilis.

Las especies del género Littorina han sido ampliamente estudiadas por los biólogos evolutivos, y especialmente por nuestro grupo de investigación, debido a diversos rasgos que las convierten en organismos modelo ideales (Rolán-Alvarez et al. 2015a). Para nuestros propósitos, cabe destacar uno de estos rasgos: la abundancia de cópulas en la naturaleza, lo cual permite estudiar fácilmente los procesos evolutivos relacionados con el sexo y la reproducción.
La NFDS y los patrones reproductivos
En ciertos estudios, se ha relacionado el patrón de reproducción de una especie con el mantenimiento del polimorfismo de color a través de NFDS. Para entender por qué, es necesario en primer lugar explicar brevemente dos conceptos: el apareamiento asociativo negativo y la elección de pareja.
Empecemos por este último: la elección de pareja a menudo se define como la propensión conductual a aparearse con aquellos individuos que tienen unos rasgos determinados. Es decir, se trata de un mecanismo de comportamiento por el cual los individuos de algún modo prefieren aparearse con ejemplares que poseen unas determinadas características físicas. Por ejemplo, en el caso de los pavos reales, se dice que las hembras tienen una propensión conductual a aparearse con aquellos machos que presentan una cola vistosa y de gran tamaño.
Por otro lado, los biólogos definen el apareamiento asociativo negativo como la correlación negativa que se da entre los fenotipos homólogos de los individuos involucrados en un apareamiento. O, en otras palabras, el fenómeno por el cual los individuos que se aparean son distintos entre sí en algún rasgo fenotípico determinado. Por ejemplo, puede ser que los individuos involucrados en una cópula tengan un color de piel distinto, o un tamaño diferente de pico, etc.
El apareamiento negativo asociativo y la elección de pareja están íntimamente relacionados. Así, por ejemplo, en muchas ocasiones el primero (apareamiento asociativo negativo) está causado por el segundo (elección de pareja).
Además de eso, el apareamiento asociativo negativo ha sido relacionado con la NFDS tanto a nivel teórico como empírico. La idea clave es que, al aparearse con aquellos individuos que son distintos a uno mismo, los caracoles pueden premiar a aquellos ejemplares que están en menor frecuencia en la población, haciendo que esta frecuencia suba a lo largo de las generaciones y que los distintos colores no desaparezcan de la población.
En la práctica, los anteriores vínculos indican que, si se encuentra apareamiento asociativo negativo en las cópulas de una especie polimórfica, entonces se podría pensar que el polimorfismo de dicha especie está causado por NFDS. Así, el apareamiento asociativo negativo puede ser empleado como indicador tanto de la elección de pareja como de la NFDS.
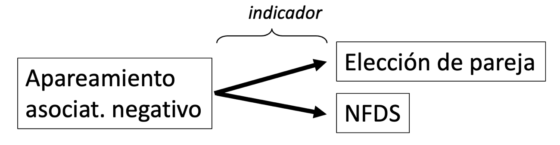
En efecto, esto es lo que nuestro grupo ha encontrado en estudios previos con la especie L. fabalis. En L. fabalis, el polimorfismo de color parece estar mantenido por NFDS a través de un mecanismo conductual de elección de pareja. Nuestro grupo determinó esta relación, entre otras cosas, detectando la existencia de apareamiento asociativo negativo.
En cualquier caso, el alcance filogenético de esta asociación no se conoce; es decir, no se sabe si otras especies del género Littorina, que habitan en un entorno similar, también pueden estar manteniendo sus respectivos polimorfismos de color a través de NFDS.
Por este motivo, nuestro grupo ha realizado un nuevo estudio, de reciente publicación en la revista Marine Biology (Gefaell et al. 2021), en el cual tratamos de responder exactamente a ese interrogante estudiando si en las cópulas de varias especies del género Littorina puede existir algún tipo de NFDS mediado por apareamiento asociativo negativo.
Averiguar si el polimorfismo de color de otras especies del género Littorina se mantiene a través de NFDS puede contribuir a averiguar el alcance explicativo de este mecanismo evolutivo tanto en el género Littorina como en otros gasterópodos marinos, avanzando así nuestro conocimiento de la evolución y la conservación de estas especies en sus entornos naturales.
Metodología seguida en nuestro estudio
Para llevar a cabo nuestro estudio, tomamos datos de cópulas en el campo de las especies L. obtusata y L. saxatilis, además de nuevas poblaciones de L. fabalis. Dichos datos provenían de poblaciones del interior de las distintas Rías Baixas, así como de dos localidades bien estudiadas del Mar Blanco (Rusia). El motivo de la elección de las anteriores especies es que todas ellas comparten un patrón similar de polimorfismo, en el cual los colores más frecuentes son el marrón oscuro, el naranja y el amarillo, distinguiéndose únicamente en el color oliva (L. fabalis y L. obtusata) y el blanco (presente solo en L. saxatilis).
El protocolo de recogida de cópulas en el campo para estudiar el apareamiento asociativo no causó problemas, pues está bien establecido. De hecho, nuestro grupo ha diseñado un método que permite evitar sesgos en la recogida y análisis de datos relativos a las cópulas, lo cual nos permite concluir que la información obtenida es fiable.
Lo mismo sucede con la estimación del apareamiento asociativo negativo: nuestro equipo ha diseñado un programa de ordenador que permite estimar este parámetro de una manera rápida y robusta. Dicho programa mide el apareamiento asociativo a través del índice conocido como IPSI. En pocas palabras, el IPSI cuantifica entre -1 y 1 en qué medida los apareamientos observados se desvían de un patrón de apareamiento aleatorio. Así, un apareamiento asociativo negativo perfecto obtendría un valor de -1 y un apareamiento asociativo positivo perfecto equivaldría a 1. Por último, un apareamiento completamente aleatorio rondaría el 0.
Resultados principales
Pues bien, una vez analizado el IPSI, ¿qué resultados obtuvimos?
Si agrupamos los distintos colores de las tres especies en dos grandes categorías, correspondientes a los colores “claros” y los “oscuros” (algo que está justificado en base a análisis previos de espectrometría de reflectancia), lo que observamos es un patrón claro: todas estas especies muestran una clara tendencia hacia el apareamiento asociativo negativo. Así, los valores de IPSI están comprendidos entre -0.59 y -0.33, tal y como se puede ver en la siguiente tabla.
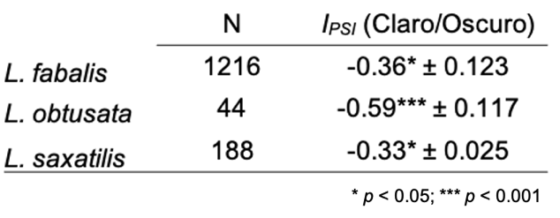
En este sentido, pensamos que está suficientemente justificado asumir la existencia de apareamiento asociativo negativo en las tres especies estudiadas. Ahora bien, cuando se analizan más en detalle los resultados, desglosándolos por colores y localidades, se advierte una excepción a esta pauta que puede darnos pistas acerca de las presiones selectivas a las que puede estar sometido el color.
En una población de L. fabalis de Cangas, el apareamiento asociativo es de naturaleza positiva (si bien no significativa), al contrario de lo que sucede con el resto de especies y poblaciones.
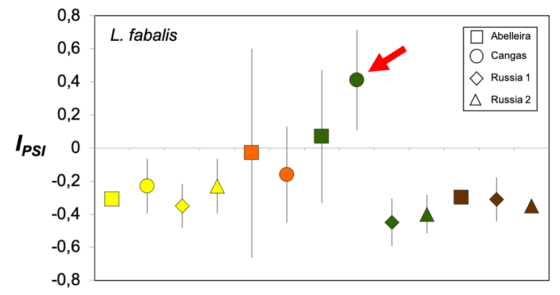
Tal y como discutimos en nuestro artículo, este resultado discordante sugiere que el verdadero objeto de la selección en esta especie (aquello que favorece la reproducción) no es el color de la concha en sí, sino algún otro rasgo correlacionado con este a nivel genético.
Conclusiones
En definitiva, a partir de nuestro artículo se pueden extraer dos conclusiones: (1) el apareamiento asociativo negativo es un hecho en las tres especies de Littorina analizadas. Esto sugiere que la NFDS y la elección de pareja pueden jugar un papel clave en el mantenimiento del polimorfismo de color de la concha y que la elección de pareja puede ser un rasgo conductual ancestral en el género Littorina.
Y (2), que el color de la concha puede estar relacionado genéticamente con algún otro carácter fenotípico que sea el verdadero objeto de la selección y la elección de pareja.
Como sucede habitualmente en la ciencia, estas dos conclusiones abren futuras vías de investigación, que nuestro grupo tratará de abordar en los próximos meses. Una de estas vías tiene que ver con el diseño y ejecución de un experimento que permita corroborar la existencia de elección de pareja en estas especies. De ese modo, se podrá evaluar más directamente la importancia de la NFDS en el mantenimiento del polimorfismo de color de Littorina. Por otro lado, una segunda vía está relacionada con el estudio de las bases moleculares del color de la concha, para tratar de determinar si en efecto este rasgo está asociado a otros caracteres potencialmente adaptativos.
¡Os mantendremos informados de futuros progresos en ambas líneas de investigación!
Agradecimientos
El presente estudio ha sido financiado gracias al proyecto de investigación CGL2016-75482-P del Ministerio de Economía, Industria y Competitividad (IP, Emilio Rolán-Alvarez), así como gracias a dos ayudas predoctorales de la Universidad de Vigo (PREUVIGO/00VI 131H 641.02) y de la Xunta de Galicia (ED481A-2021/274).
Referencias
Gefaell J, Galindo J, Malvido C, Nuñez V, Estévez D, Blanco S, González-Conde M, Martínez-Domínguez S, Pérez-Fernández G, Rus B, Mosconi I, Rolán-Alvarez E (2021) Negative assortative mating and maintenance of shell colour polymorphism in Littorina (Neritrema) species. Marine Biology, 168:151. doi: 10.21203/rs.3.rs-242300/v1
Rolán-Alvarez E, Austin CJ, Boulding EG (2015a) The contribution of the genus Littorina to the field of evolutionary ecology. En: Hughes RN, Hughes DJ, Smith IP, Dale AC (eds). Oceanogr Mar Biol, vol. 53. CRC Press, Boca Ratón, 157-214
Sobre el autor: Juan Gefaell se graduó en psicología en la Universidad Pontificia de Salamanca y en biología en la Universidad de Vigo; tras cursar un máster en lógica, historia y filosofía de la ciencia en la UNED, en la actualidad realiza su doctorado en biología evolutiva en el departamento de Bioquímica, Genética e Inmunología de la Facultad de Biología de la Universidad de Vigo.
Nuevo artículo divulgativo – Juan Gefaell
[…] de las frecuencias, entre otras cosas. Para acercar los resultados al público general, he escrito el siguiente artículo en el que explico de forma sencilla el contexto, los métodos y los principales resultados de […]