Cómo (potencialmente) reparar el cerebro usando las muelas del juicio
Una de las citas más famosas de Santiago Ramón y Cajal en su obra “Reglas y consejos sobre la investigación científica” fue: “Todo hombre puede, si así lo desea, convertirse en escultor de su propio cerebro”. [1] Sin embargo, el uso de material dental como piedras y argamasa para modelar o reparar esculturas probablemente sonaba a ciencia ficción en su época…
El sistema nervioso central (SNC) humano tiene una capacidad muy limitada de autorreparación. De hecho, la recuperación tras traumatismos craneoencefálicos o enfermedades neurodegenerativas es todo un reto, centrándose en proteger y estimular la plasticidad (reconectar las neuronas) de las células neuronales vivas restantes. Por esta razón, los tratamientos tradicionales a menudo se centran en el control de los síntomas en lugar de en la regeneración tisular. En el campo de la terapia celular, las células madre ofrecen una ventaja innegable, dado que son moldeables: su función es ser un reservorio celular con material genético intacto e impoluto, listo para activar la célula para su integración en un entorno dañado.
En teoría, la terapia con células madre presenta una vía prometedora para la reparación del SNC; sin embargo, las desventajas actuales son 1) El SNC constituye un entorno muy particular donde solo se encuentran los elementos esenciales de una manera perfectamente organizada, y cualquier elemento adicional es un obstáculo y 2) la obtención de células madre apropiadas sigue siendo un obstáculo, ya que es bien sabido que las células madre normales a veces pueden transformarse en células madre cancerígenas, lo que puede contribuir a una tumorogénesis potencialmente mortal en el órgano donde se hubiésen injertado. De hecho, existen múltiples tumores en los que se ha identificado la presencia de células madre cancerígenas incluyendo: cerebro, mama, hígado, páncreas, colon, pulmón, estómago, próstata, piel, hígado, ovario, hueso e incluso leucemia mieloide [2-9].
Células madre de la pulpa dental humana
Curiosamente, las células madre de la pulpa dental humana (hDPSC) son un tipo especial de célula madre derivada de la pulpa dental de dientes extraídos, de las cuales no se ha descrito capacidad tumorígena hasta la fecha [10]. Además, la ausencia de modificación genética intrusiva para diferenciarlas hacia un fenotipo neuronal postmitótico les otorga garantías de seguridad adicionales [11]. Otra ventaja importante de su uso, es que ofrecen una fuente celular accesible y éticamente transparente, con el potencial de diferenciarse en diversos tipos celulares y secretar factores neuroprotectores beneficiosos para la supervivencia y el crecimiento neuronal.
El mayor reto actual reside en encontrar la manera de crear una célula neuronal funcional a partir de una célula madre humana adulta no derivada del SNC (como las Hdpsc). En investigación, el trabajo siempre supone una evolución del trabajo previo. En 2004, hace 21 años, investigadores de la Universidad de Barcelona lograron diferenciar neuronas a partir de precursores embrionarios de células estriatales de rata, capaces de integrarse en cerebros dañados [12]. En el trabajo actual de Pardo-Rodríguez et al. uno de aquellos colaboradores pensó la posibilidad de, basándose en modificaciones del protocolo previamente publicado, tartar de integrar los requisitos del cultivo de células madre humanas adultas y las señales y estímulos adecuados para generar neuronas funcionales a partir de hDPSC [13].
Mejorar los protocolos existentes
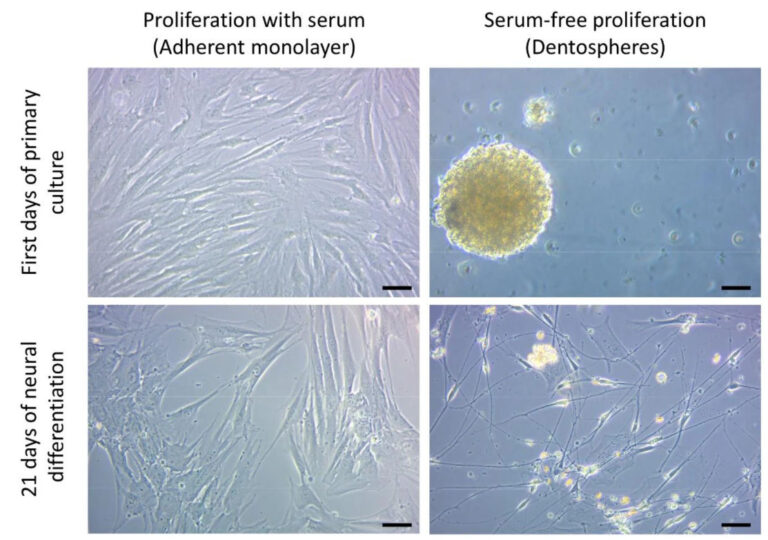
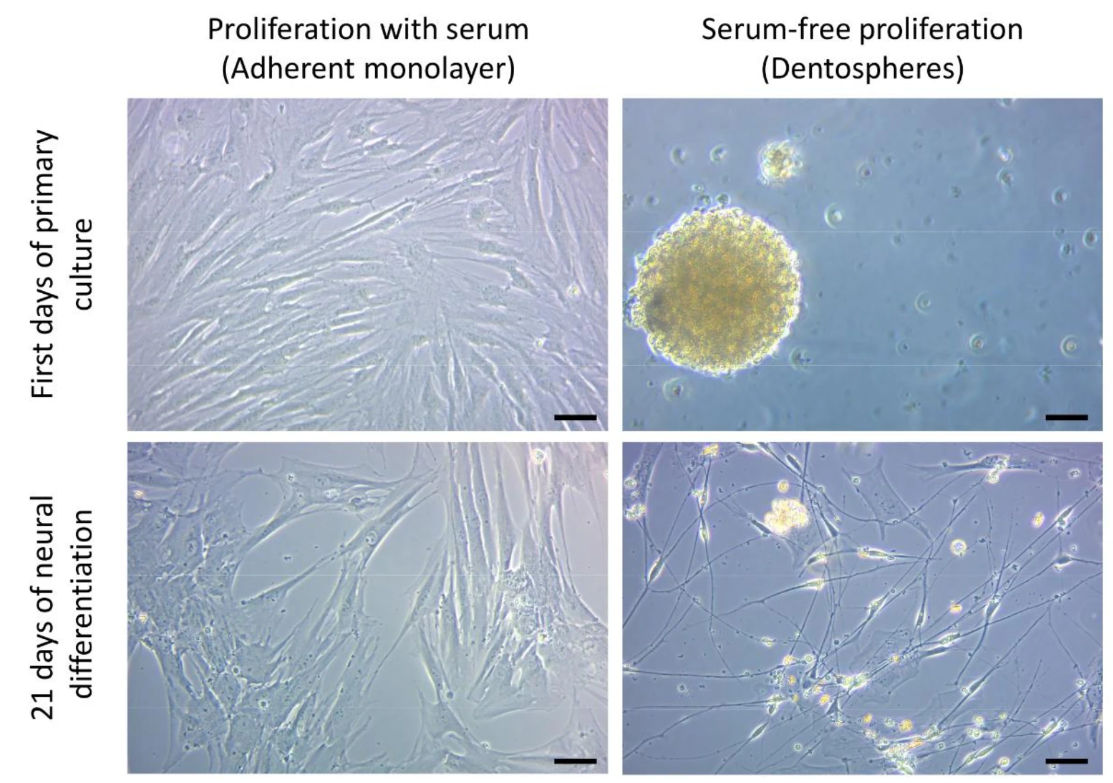
Así, el objetivo principal del estudio fue mejorar los protocolos existentes para el cultivo de hDPSC. La presencia de suero en los medios de cultivo (10% de suero fetal bovino o FBS) suele favorecer la supervivencia y el crecimiento de las células. Sin embargo, la presencia sostenida de FBS a lo largo del tiempo limita el potencial de diferenciación de las células madre. La diferenciación celular es como un viaje en el que la dirección debe decidirse cuidadosamente, ya que no se puede llegar a todos los puntos cardinales a la vez. El estudio evaluó el impacto de la presencia de suero durante la fase de expansión inicial en la diferenciación neuronal posterior. Se seleccionaron medios de cultivo sin suero, más específicos para células madre neurales, lo que permitió la generación de cultivos esferoides (dentosferas) similares a las neuroesferas. Los resultados mostraron que las hDPSC cultivadas inicialmente en condiciones sin suero (esferoides) mostraron una mayor propensión a la diferenciación neuronal en comparación con las cultivadas con FBS (Figura 1).
A continuación, se mejoró el protocolo de diferenciación de antaño, mediante la incorporación de pulsos de ácido retinoico (AR) y cloruro de potasio (KCl). Tras la fase inicial de cultivo, las células se sometieron a un medio de inducción neuronal durante 21 o 60 días, suplementado con AR y KCl para promover la diferenciación neuronal. Se caracterizaron las características moleculares y morfológicas de las células diferenciadas mediante la reacción en cadena de la polimerasa cuantitativa con transcripción inversa (RT-qPCR, utilizada para cuantificar los niveles de expresión génica de marcadores neuronales y subunidades de canales iónicos) y la técnica de inmunofluorescencia (esta técnica permite detectar específicamente la presencia de componentes celulares específicos, como en este caso los marcadores neuronales). Además, realizaron un análisis morfométrico digital mediante 3D-Sholl (un análisis de imagen específico para evaluar la morfología celular y la complejidad del crecimiento de las neuritas (que define la forma neuronal)).
Los resultados mostraron que los cultivos sin suero aumentaron la expresión de marcadores neuronales progenitores como Nestina, GFAP, S100β y p75NTR. Tras la diferenciación de las hDPSC, las células expresaron marcadores neuronales como doblecortina (DCX), antígeno nuclear neuronal (NeuN), anquirina-G y proteína asociada a microtúbulos 2 (MAP2), junto con la presencia de proteínas presinápticas (vGLUT2, sinapsina-I) y proteínas de andamiaje postsinápticas asociadas con sinapsis excitatorias (glutamatérgicas) e inhibitorias (GABAérgicas), lo que sugiere su potencial para formar estructuras sinápticas. Finalmente, las características funcionales de las células obtenidas se evaluaron mediante análisis electrofisiológico utilizando registros de fijación de parche de célula completa (esta técnica evalúa las propiedades eléctricas funcionales de las células diferenciadas). Los resultados mostraron que las hDPSC diferenciadas tenían corrientes de potasio (K⁺) dependientes de voltaje y de sodio (Na⁺) sensibles a la tetrodotoxina (TTX), que son esenciales para la generación del potencial de acción. Además, las células generadas exhibieron actividad electrofisiológica espontánea y pudieron generar potenciales de acción repetitivos con recuperación total del potencial basal, demostrando una excitabilidad funcional similar a la de las neuronas. La conclusión es que el tratamiento con AR y KCl condujo a una regulación positiva de las subunidades de los canales de Na⁺ y K⁺ dependientes de voltaje a nivel de transcripción y proteína, correlacionándose así con las propiedades electrofisiológicas observadas.
En conclusión, el cultivo de hDPSC en condiciones sin suero antes de la diferenciación mejoró su capacidad de diferenciación neuronal, y la incorporación de AR y KCl en el protocolo de diferenciación promovió eficazmente un proceso de maduración exitoso, donde las células generaron impulsos eléctricos característicos de las neuronas maduras. Este estudio demuestra que las hDPSC pueden diferenciarse eficazmente en células neuronales con actividad electrofisiológica funcional, sin modificación genética extrínseca.
La generación exitosa de células neuronales funcionales a partir de hDPSC abre nuevas vías para la creación de modelos in vitro para enfermedades neurodegenerativas y el cribado de fármacos. Se podrían desarrollar nuevas estrategias de trasplante autólogo para reemplazar neuronas perdidas o dañadas en pacientes con lesiones del SNC o enfermedades degenerativas. Se espera que este estudio impulse nuevos avances en el campo de la medicina regenerativa, al proporcionar una fuente confiable y ética de células neuronales funcionales para futuras aplicaciones de investigación traslacional.
Como dijo Cajal, “las ideas no perduran a menos que se tenga la determinación y la valentía de llevarlas a cabo”.
Referencias:
[1] Ramón y Cajal, Santiago (2016). Reglas y consejos sobre investigación científica. Los tónicos de la voluntad (en español). Gadir. ISBN 9788494576584.
[2] Sheila K Singh, Cynthia Hawkins, Ian D Clarke, Jeremy A Squire, Jane Bayani, Takuichiro Hide, R Mark Henkelman, Michael D Cusimano, Peter B Dirks. Identification of human brain tumour initiating cells. Nature. 2004 Nov 18;432(7015):396-401. doi: 10.1038/nature03128.
[3] Muhammad Al-Hajj, Max S Wicha, Adalberto Benito-Hernandez, Sean J Morrison, Michael F Clarke. Prospective identification of tumorigenic breast cancer cells. Proc Natl Acad Sci U S A. 2003 Apr 1;100(7):3983-8. doi: 10.1073/pnas.0530291100.
[4] A Eramo, F Lotti, G Sette, E Pilozzi, M Biffoni, A Di Virgilio, C Conticello, L Ruco, C Peschle, R De Maria. Identification and expansion of the tumorigenic lung cancer stem cell population. Cell Death Differ. 2008 Mar;15(3):504-14. doi: 10.1038/sj.cdd.4402283.
[5] Collins AT, Berry PA, Hyde C, Stower MJ, Maitland NJ. Prospective identification of tumorigenic prostate cancer stem cells. Cancer Res. 2005 Dec 1;65(23):10946-51. doi: 10.1158/0008-5472.CAN-05-2018.
[6] Yamashita T, Ji J, Budhu A, Forgues M, Yang W, Wang HY, Jia H, Ye Q, Qin LX, Wauthier E, Reid LM, Minato H, Honda M, Kaneko S, Tang ZY, Wang XW. EpCAM-positive hepatocellular carcinoma cells are tumor-initiating cells with stem/progenitor cell features. Gastroenterology. 2009 Mar;136(3):1012-24. doi: 10.1053/j.gastro.2008.12.004.
[7] D Bonnet, J E Dick. Human acute myeloid leukemia is organized as a hierarchy that originates from a primitive hematopoietic cell. Nat Med. 1997 Jul;3(7):730-7. doi: 10.1038/nm0797-730.
[8] Jamieson CH, Ailles LE, Dylla SJ, Muijtjens M, Jones C, Zehnder JL, Gotlib J, Li K, Manz MG, Keating A, Sawyers CL, Weissman IL. Granulocyte-macrophage progenitors as candidate leukemic stem cells in blast-crisis CML. N Engl J Med. 2004 Aug 12;351(7):657-67. doi: 10.1056/NEJMoa040258.
[9] Pineda JR, Badiola I, Ibarretxe G. Stem and Cancer Stem Cell Identities, Cellular Markers, Niche Environment and Response to Treatments to Unravel New Therapeutic Targets. Biology (Basel). 2021 Jan 2;10(1):25. doi: 10.3390/biology10010025.
[10] Crende O, García-Gallastegui P, Luzuriaga J, Badiola I, de la Hoz C, Unda F, Ibarretxe G, Pineda JR. Is There Such a Thing as a Genuine Cancer Stem Cell Marker? Perspectives from the Gut, the Brain and the Dental Pulp. Biology (Basel). 2020 Nov 27;9(12):426. doi: 10.3390/biology9120426.
[11] Luzuriaga J, Polo Y, Pastor-Alonso O, Pardo-Rodríguez B, Larrañaga A, Unda F, Sarasua JR, Pineda JR, Ibarretxe G. Advances and Perspectives in Dental Pulp Stem Cell Based Neuroregeneration Therapies. Int J Mol Sci. 2021 Mar 29;22(7):3546. doi: 10.3390/ijms22073546.
[12] Bosch M, Pineda JR, Suñol C, Petriz J, Cattaneo E, Alberch J, Canals JM. Induction of GABAergic phenotype in a neural stem cell line for transplantation in an excitotoxic model of Huntington’s disease. Exp Neurol. 2004 Nov;190(1):42-58. doi: 10.1016/j.expneurol.2004.06.027.
[13] Pardo-Rodríguez B, Baraibar AM, Manero-Roig I, Luzuriaga J, Salvador-Moya J, Polo Y, Basanta-Torres R, Unda F, Mato S, Ibarretxe G, Pineda JR. Functional differentiation of human dental pulp stem cells into neuron-like cells exhibiting electrophysiological activity. Stem Cell Res Ther. 2025 Jan 23;16(1):10. doi: 10.1186/s13287-025-04134-7.
Sobre los autores: Beatriz Pardo-Rodríguez, Gaskon Ibarretxe y José R. Pineda. Departamento de Biología Celular e Histología. Facultad de Medicina y Enfermería de la Universidad del País Vasco (UPV/EHU).