Hace más de un año que Laura Morrón me preguntó cómo se dirigía un “nanofármaco” hacia un órgano en concreto, así que este artículo es una ampliación de la respuesta que le di con un ejemplo muy determinado.
Hablamos de administración dirigida de fármacos (controlled drug delivery) cuando nuestro sistema está diseñado para liberar el fármaco de una manera predeterminada. Lo que se pretende con este tipo de sistemas es mejorar la efectividad de la terapia: consiguiendo una elevada concentración de fármaco en sangre durante un período prolongado de tiempo, y así evitar las fluctuaciones en la concentración de fármaco y también la necesidad de administrar varias dosis.
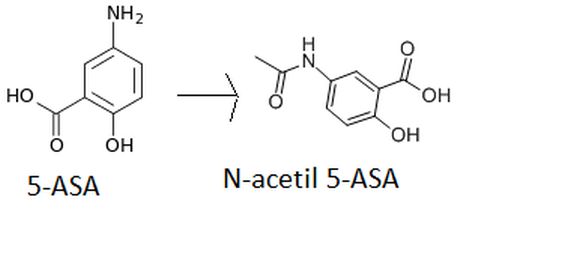 En este caso en concreto, se trataba de diseñar un sistema para la enfermedad inflamatoria intestinal, que se caracteriza por desórdenes inflamatorios idiopáticos recurrentes que afectan a la mucosa y la submucosa del colon. El fármaco ácido 5-aminosalicílico (5-ASA, también conocido como mesalazina) es anti-inflamatorio y se puede emplear para este trastorno. El problema es que, tras su administración oral, se adsorbe rápidamente en la parte superior del tracto gastrointestinal y se metaboliza a N-acetil-5-ASA, que no tiene actividad terapéutica. Por lo tanto, el reto está en conseguir que el fármaco 5-ASA llegue sin metabolizar a la mucosa de colon. ¿Cómo? Una estrategia podría ser encapsular el fármaco dentro de un polímero gastrorresistente. Además, interesa que todo este sistema esté nanoparticulado, porque se conoce que las nanopartículas se acumulan específicamente en los tejidos inflamados de colon, según su tamaño: a menor diámetro, mas acumulación.
En este caso en concreto, se trataba de diseñar un sistema para la enfermedad inflamatoria intestinal, que se caracteriza por desórdenes inflamatorios idiopáticos recurrentes que afectan a la mucosa y la submucosa del colon. El fármaco ácido 5-aminosalicílico (5-ASA, también conocido como mesalazina) es anti-inflamatorio y se puede emplear para este trastorno. El problema es que, tras su administración oral, se adsorbe rápidamente en la parte superior del tracto gastrointestinal y se metaboliza a N-acetil-5-ASA, que no tiene actividad terapéutica. Por lo tanto, el reto está en conseguir que el fármaco 5-ASA llegue sin metabolizar a la mucosa de colon. ¿Cómo? Una estrategia podría ser encapsular el fármaco dentro de un polímero gastrorresistente. Además, interesa que todo este sistema esté nanoparticulado, porque se conoce que las nanopartículas se acumulan específicamente en los tejidos inflamados de colon, según su tamaño: a menor diámetro, mas acumulación.
El polímero elegido como matriz del fármaco fue Eudragit S100 (EU S100), que es un copolímero aniónico basado en ácido metacrílico y metacrilato de metilo (relación 1:2). Mientras que es insoluble en ácidos (lo que nos interesa para que 5-ASA no se metabolice al pH del estómago), sí que es soluble a pH mayor o igual que 7, es decir: es soluble en colon.
Y ahora que tenemos el fármaco y el polímero, ¿cómo lo encapsulamos?
Una forma, tal y como conté en Bilbao, son las tecnologías basadas en fluidos supercríticos (porque, entre otras cosas, permiten reducir la presencia de disolventes orgánicos, exigido por la regulación internacional para productos farmacéuticos). En la técnica PCA/GAS/SAS (gas antisolvent/precipitation with a compressed antisolvent) se usa el poder antisolvente del CO2 comprimido para precipitar nuestros compuestos. Para ello, necesitamos disolver primero tanto el fármaco 5-ASA como el polímero Eudragit, que es uno de los pasos críticos de todo el proceso…, ya que 5-ASA es un compuesto hidrofílico insoluble en la mayoría de disolventes orgánicos aptos para la técnica PCA. Al final se optó por una mezcla de DMSO (disolvente polar en el que sí es soluble el 5-ASA) y acetona (disolvente para el Eudragit). La relación DMSO/acetona se elige en base a una serie de principios:
- Que nos interesa el disolvente con una mayor volatilidad ya que induce un mayor volumen de expansión, y se elimina más rápido del sistema.
- La solubilidad del polímero en el disolvente orgánico debe ser mayor que la del fármaco porque nos interesa que primero precipite el fármaco, y sobre él el polímero que lo encapsule.
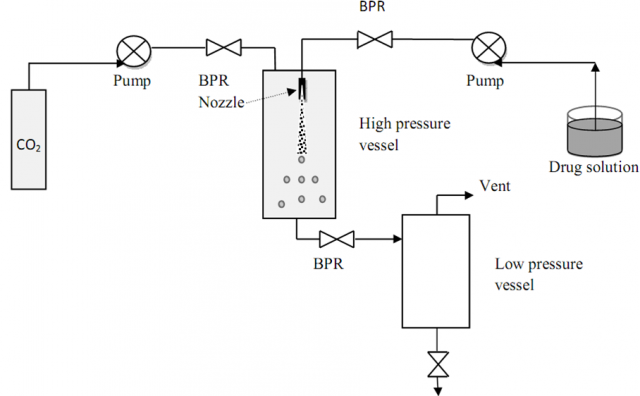 La técnica PCA, tiene 4 etapas. En la primera, se acondiciona nuestro reactor a la temperatura de trabajo, y a la presión de trabajo bombeando un flujo constante de CO2 (regulado por una válvula de dosificación). En la segunda, la disolución fármaco-polímero se introduce dentro de la cámara de precipitación a través de un pulverizador de tipo spray. El CO2 hace precipitar nuestra disolución en un separador ciclónico. Una vez hemos acabado de pulverizar nuestra disolución, en la tercera etapa, se sigue pasando el flujo de CO2 para secar el polvo nanoestructurado de Eudragit encapsulando 5-ASA (con suerte). Es necesario calentar las zona de la válvula de dosificación ya que debido a la expansión del CO2 se congela (el dichoso secador alcanza un montón de grados y da un calor en veranito…). La última etapa consiste en la despresurización del reactor.
La técnica PCA, tiene 4 etapas. En la primera, se acondiciona nuestro reactor a la temperatura de trabajo, y a la presión de trabajo bombeando un flujo constante de CO2 (regulado por una válvula de dosificación). En la segunda, la disolución fármaco-polímero se introduce dentro de la cámara de precipitación a través de un pulverizador de tipo spray. El CO2 hace precipitar nuestra disolución en un separador ciclónico. Una vez hemos acabado de pulverizar nuestra disolución, en la tercera etapa, se sigue pasando el flujo de CO2 para secar el polvo nanoestructurado de Eudragit encapsulando 5-ASA (con suerte). Es necesario calentar las zona de la válvula de dosificación ya que debido a la expansión del CO2 se congela (el dichoso secador alcanza un montón de grados y da un calor en veranito…). La última etapa consiste en la despresurización del reactor.
Este estudio pretendía correlacionar las variables del proceso (como la presión y la temperatura de trabajo, la concentración de fármaco 5-ASA, y la velocidad de flujo en la inyección de la disolución fármaco-polímero) con la morfología, el tamaño de partícula y la eficiencia de encapsulación. Es decir, una vez acabado el experimento PCA, el polvo obtenido (ni os imagináis las risas que me he echado hablando de polvo…) se tiene que caracterizar por distintas técnicas fisicoquímicas.
Yo no puedo evitar que este tipo de imágenes me recuerden a la Tierra Media ![]()
Por microscopía SEM, se pudo determinar que cuando se trabajaba a 12-15 MPa de presión, la morfología de las nanopartículas obtenidas era esférica y de superficie lisa; mientras que con 8 MPa la morfología era más irregular. Para que las nanopartículas se produzcan es necesario que la presión de trabajo esté por encima del punto crítico de la mezcla CO2-DMSO-acetona, que tal y como se determinó experimentalmente está por encima de 8 MPa. Asimismo, a 12-15 MPa se obtenían tamaños de partículas menores que con 8 MPa.
También se determinó que la temperatura óptima de trabajo eran 35 ºC frente a 40 ºC, probablemente por una mayor interacción del polímero Eudragit con el CO2 (plastificación), que influía en la morfología de las nanopartículas y en la eficiencia de encapsulación.
Suele ocurrir que lo mejor es enemigo de lo bueno…, así que cuanto más concentrado se ponía el fármaco 5-ASA, era perjudicial para la morfología y el tamaño de partícula, y para el rendimiento de encapsulación (quizá porque no hay suficiente polímero para encapsular 5-ASA).
Otras técnicas mostraron una reducción de la cristalinidad del fármaco 5-ASA (por XRD) o la desaparición del pico endotérmico del fármaco (por DSC), sugiriendo que el fármaco 5-ASA estaría embebido en la matriz del polímero Eudragit. Los espectros de FTIR indicaron que no se había modificado la estructura molecular del fármaco, por lo tanto el proceso PCA es adecuado para preparar las nanopartículas.
Como señalaba al principio, este es un ejemplo muy concreto de administración dirigida de fármacos, y hay muchas más posibilidades esta que cuenta Raven, o las famosas ciclodextrinas de Scientia. La que he contado es la que me pilla más cerca, porque se parece al proyecto con el que empecé a trabajar en investigación.
Este post ha sido realizado por Dolores Bueno (@Ununcuadio) y es una colaboración de Naukas con la Cátedra de Cultura Científica de la UPV/EHU.
Referencias científicas y más información:
El trabajo que he contado es: Hu, D., Liu, L., Chen, W., Li, S., & Zhao, Y. (2012). A Novel Preparation Method for 5-Aminosalicylic Acid Loaded Eudragit S100 Nanoparticles International Journal of Molecular Sciences, 13 (12), 6454-6468 DOI: 10.3390/ijms13056454
También he usado, información general de: Duarte, A., Roy, C., Vega-González, A., Duarte, C., & Subra-Paternault, P. (2007). Preparation of acetazolamide composite microparticles by supercritical anti-solvent techniques International Journal of Pharmaceutics, 332 (1-2), 132-139 DOI: 10.1016/j.ijpharm.2006.09.041

Lo Mejor de la Semana (10-16 de mayo) | Hablando de Ciencia | Artículos
[…] tiempo le pregunté a Dolores cómo se dirigía un radiofármaco a un órgano concreto y, como extraordinaria divulgadora que es, me ha respondido con una entrada interesantísima en el […]
Dirigiendo nanofármacos a colon | Naukas…
[…] Hace más de un año que Laura Morrón me preguntó cómo se dirigía un “nanofármaco” hacia un órgano en concreto, así que este artículo es una ampliación de la respuesta que le di con un ejemplo muy determinado. Hablamos de administración […]