Ha vuelto a ocurrir. Lo publicaba la farmacéutica con sede en Indianápolis en New England Journal of Medicine el pasado 24 de enero. El último de los grandes estudios Expedition, el tercero de la saga para ser exactos, ha fallado. Después de las noticias de hace un par de años, creo que todos nos lo temíamos. El solanezumab (acabado en “-mab” por lo de “monoclonal antibody”) no disminuye significativamente el deterioro cognitivo asociado a la enfermedad de Alzheimer. La ventaja competitiva inicial de este anticuerpo es que estaba dirigido contra el amiloide soluble monomérico, una estrategia que pretendía disminuir las especies de amiloide soluble en el cerebro y así evitar la formación de placas seniles.
Se trataba de un Fase III. Con más de 2.000 pacientes. El mayor estudio hecho hasta la fecha sobre la modulación del amiloide en la enfermedad de Alzheimer. Expedition 3 ha comparado 1.057 enfermos tratados con el anticuerpo contra 1.072 que han recibido placebo. El fármaco ha sido administrado intravenosamente a una dosis mensual de 400 mg durante 80 semanas. A las 28 semanas de tratamiento, y también en las semanas 52 y 64, los resultados parecían indicar un eventual efecto positivo que finalmente se he difuminado en los últimos puntos de la cinética de la enfermedad. Como siempre, parece que algo hace, pero cuando se estudia la significación estadística el beneficio se pierde como lágrimas en la lluvia.

Como decía Viktor Frankl en “El hombre en busca de sentido”, el que tiene un porqué siempre encuentra un cómo. Así que afirman los investigadores que tal vez el fármaco no falle, y que la ausencia de beneficio terapéutico sea consecuencia de que la cantidad utilizada de anticuerpo no haya sido lo suficientemente alta como para haber producido efectos claros. O que el tratamiento se empezó cuando la enfermedad estaba demasiado avanzada, aunque hay que recordar que entre los criterios de reclutamiento se especificaba que los enfermos de alzhéimer a utilizar en el estudio estarían en la fase leve de la enfermedad. De hecho, su investigador principal, Lawrence Honig, del Columbia University Medical Center en Nueva York, afirma que, a pesar de los resultados del Expedition 3, sigue siendo optimista con las terapias anti-amiloide.
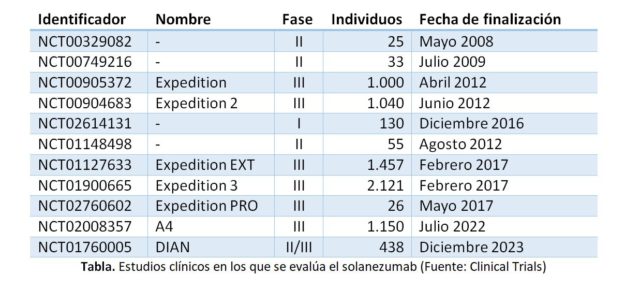
Expedition 3 es el tercer gran estudio de la farmacéutica americana con este anticuerpo, tras los fracasos del Expedition original en 2012 y el Expedition 2 en 2016 (el Expedition EXT es una extensión de los pacientes de las dos primeras expediciones farmacológicas). Ambos sumaron más de dos mil pacientes, de los casi 7.500 que se han incluido en los estudios con este fármaco. En ninguno de ellos la mejoría de los pacientes fue lo suficientemente clara.
El comienzo tardío del tratamiento en relación al avance de la enfermedad es el argumento más utilizado en los últimos años para justificar la ausencia de efectos de los anticuerpos anti-amiloide. Se repite constantemente como un mantra en congresos especializados y en publicaciones científicas; nos hemos equivocado en cuándo iniciar el tratamiento. Pero una y otra vez siguen fallando los estudios clínicos que atacan a esta diana. Si esto es así, el momento idóneo sería tratar a los enfermos antes de que empiece el declive cognitivo, pero anticipar qué persona va a desarrollar la enfermedad es realmente complicado, y de hecho medio planeta está trabajando en ello. A no ser que utilicemos la variante familiar y hereditaria de la enfermedad, aunque hay que recordar que esta tipología del alzhéimer es realmente rara y no sabemos aún si se regirá por los mismos principios fisiopatológicos que la variante más abundante de la enfermedad, la llamada “esporádica” o “no familiar”.
Por esta razón se han diseñado y puesto en marcha los estudios A4 y DIAN. El A4 es el último intento de la compañía americana para ver el efecto del solanezumab. Se está probando en altas dosis en individuos mayores de 65 años con evidencia de amiloide en sus cerebros, pero que todavía estén cognitivamente sanos. Por su parte, DIAN es un acrónimo de Dominantly Inherited Alzheimer Network, y es una iniciativa donde se evaluarán hasta tres fármacos (dos de ellos anticuerpos contra el amiloide y el otro también relacionado con su producción) de tres compañías diferentes (Eli Lilly, Hoffmann-La Roche y Janssen) en pacientes con enfermedad hereditaria, y donde los enfermos todavía están en fase asintomática o muy leve de la enfermedad. Si ninguno de estos dos ensayos funciona deberemos ir resignándonos a aceptar que probablemente el amiloide no sea el fantasma que causa la enfermedad, y deberemos aceptar que el árbol nos ha tapado el bosque durante casi treinta años de investigación, aunque hayamos aprendido enormemente por el camino. Esto último no es un consuelo, es uno de los mecanismos intrínsecos al avance de la ciencia.
A día de hoy, y según datos de la Alzheimer’s Drug Discovery Association (ADDF), la mayoría de los 126 tratamientos en fases clínicas que se estaban probando en 2017 para la enfermedad de Alzheimer seguían estando dirigidos contra el péptido amiloide. Curiosamente, esta fundación americana no financia el desarrollo de fármacos contra esta diana, la más estudiada sin lugar a dudas en la investigación contra el alzhéimer, lo que cuanto menos resulta significativo.
Las últimas noticias del Expedition 3, y las del Expedition 2 hace un par de años, me han hecho recordar un viaje que hice hace cinco años a la conferencia anual del JP Morgan en San Francisco, un bizarro evento farmacéutico que puebla de ejecutivos todos y cada uno de los rincones de la ciudad de la bahía. Los puedes ver detrás de sus corbatas mostrándose unos a otros presentaciones en los sitios más peregrinos, desde los lugares más transitados a los más recónditos, desde los sillones de los ostentosos halls de hoteles caros a las habitaciones privadas surtidas con todo tipo de lujos a cientos de metros de altura, o desde restaurantes de moda hasta las más populares cafeterías franquicia. Allí tuve la oportunidad de charlar con uno de los asesores de Eli Lilly. Íbamos caminando por Union Square cuando me dijo bajito que el solanezumab no funcionaba, pero que no quedaba más remedio que seguir para adelante, ya que se había gastado demasiado dinero y se tenía que hacer el último intento.
Ya ven, parece que el negocio del alzhéimer sigue teniendo más ambición que memoria.
Este post ha sido realizado por Javier Burgos (@Javisburgos) y es una colaboración de Naukas con la Cátedra de Cultura Científica de la UPV/EHU.
Referencias científicas y más información:
- Trial of Solanezumab for Mild Dementia Due to Alzheimer’s Disease. Honig et al. N Engl J Med. 2018 Jan 25;378(4):321-330.
- Las expediciones elementales. Javier S. Burgos. Jot Down. 2016. (http://www.jotdown.es/2016/04/las-expediciones-elementales/)
- ADDF 2017 Alzheimer’s Clinical Trial Report (https://www.alzdiscovery.org/assets/content/static/ADDF-2017-Alzheimers-Clinical-Trials-Report.pdf)

Hitos en la red #205 | Enlace Recomendado | Naukas
[…] La enfermadad de alzhéimer no tiene tratamiento. De hecho, por no tener, no tiene etiología (causa) conocida y sin ella es imposible actuar sobre la base de la enfermedad. El problema es que su desarrollo antes de dar síntomas puede llevar años, si no décadas. Esta combinación de factores lleva a un callejón sin salida en el que las compañías farmacéuticas han enterrado miles de millones de euros, sin resultado. A este respecto, lean a Javier Burgos en Alzhéimer, ¿el fin de la expedición?. […]
Eduardo Pauls
Buen artículo. Creo que se acerca la hora de la verdad para la «hipótesis amiloide» y de eso dependerán las inversiones de las farmacéuticas en los próximos años. Un comentario: en la portada de Nature que hace referencia a aducanumab, la imagen de PET de la derecha corresponde a un paciente tratado con aducanumab, no a un indiciduo sano (sin alzhéimer). De ahí lo fascinante de este anticuerpo, al que le he dedicado una entrada en un blog de divulgación que estoy empezando a montar (www.alzciencia.com). Saludos.
Los retos en la búsqueda de un tratamiento efectivo contra el alzhéimer | Arcadia Comunicaciones
[…] Sea lo que sea, lo cierto es que los ensayos clínicos de nuevos tratamientos para el Alzheimer en humanos son una decepción tras otra. Entre 2002 y 2012, los fármacos probados fracasaron en el 99.6 % de los casos. Los resultados de los ensayos de los últimos años tampoco ofrecen un panorama alentador, con más fracasos estrepitosos de fármacos inicialmente prometedores como el solanezumab. […]
Los retos en la búsqueda de un tratamiento efectivo contra el alzhéimer | Radio Huancavilca 830AM
[…] Sea lo que sea, lo cierto es que los ensayos clínicos de nuevos tratamientos para el Alzheimer en humanos son una decepción tras otra. Entre 2002 y 2012, los fármacos probados fracasaron en el 99.6 % de los casos. Los resultados de los ensayos de los últimos años tampoco ofrecen un panorama alentador, con más fracasos estrepitosos de fármacos inicialmente prometedores como el solanezumab. […]