La Facultad de Ciencias de Bilbao comenzó su andadura en el curso 1968/69. 50 años después la Facultad de Ciencia y Tecnología de la UPV/EHU celebra dicho acontecimiento dando a conocer el impacto que la Facultad ha tenido en nuestra sociedad. Publicamos en el Cuaderno de Cultura Científica y en Zientzia Kaiera una serie de artículos que narran algunas de las contribuciones más significativas realizadas a lo largo de estas cinco décadas.
Desde la expansión de la agricultura y la ganadería, que se inició en el neolítico, los humanos hemos intentado modificar la información genética de animales y plantas, en nuestro propio interés. Así lo atestiguan algunos bajorrelieves de 850 años AC, donde se aprecian dioses asirios polinizando artificialmente palmeras datileras. Hasta hace poco menos de 50 años, estas modificaciones solo podían realizarse de forma indirecta, mediante cruzamientos entre organismos de la misma especie, o de especies muy relacionadas, y la selección de aquellos descendientes que presentan los caracteres de interés (por ejemplo, un mayor tamaño, frutos más dulces, animales más dóciles, …), para realizar con ellos nuevos cruces y así, progresivamente, ir modificando la composición genética de las poblaciones, de acuerdo a nuestros intereses.
Sin embargo, en las últimas 5 décadas, se han desarrollado herramientas moleculares que permiten realizar modificaciones genéticas de manera directa. Varios grupos de investigación de la Facultad de Ciencia y Tecnología de la UPV/EHU hemos seguido muy de cerca estos avances y hemos participado activamente en algunas de sus aplicaciones. En este artículo y en los dos que le sucederán, presentamos brevemente algunos de los desarrollos más importantes en este ámbito, destacando sus aplicaciones en el campo biomédico y mencionando algunos de los debates científicos y sociales que su uso propició o que sigue generando hoy día.
El término «ingeniería genética» se acuñó a principios de los años 40 del siglo pasado. Curiosamente, los avances científicos que la hicieron posible no sucedieron hasta unos cuantos años más tarde, primero con el descubrimiento de la estructura del DNA, por Franklin,Watson y Crick en1953, y luego con el descubrimiento de la tecnología del DNA recombinante, por Cohen y Boyer en 1973 (Figura 1). La tecnología del DNA recombinante implica la unión de fragmentos de DNA, procedentes de una misma especie o de especies diferentes, para crear moléculas de DNA “híbridas” que pueden posteriormente introducirse en una célula hospedante.

En los primeros años de la tecnología del DNA recombinante, su uso generó mucha suspicacia y preocupación, por tratarse de una manipulación de la esencia misma de la vida (recordemos que el DNA se consideró la “molécula de la vida”). Se temía que estos genes híbridos llevaran consigo capacidades incontrolables para dañar a los seres humanos. Tal es así que en 1974 los propios científicos se auto-impusieron una moratoria en sus investigaciones hasta que se celebró una reunión internacional (la Conferencia de Asilomar en 1975) para debatir si la experimentación con DNA recombinante planteaba algún peligro plausible para la salud pública. En esta reunión unos 150 científicos discutieron durante días sobre los riesgos potenciales de la nueva tecnología y sobre su regulación, y elaboraron directrices voluntarias para garantizar la seguridad de la tecnología del DNA recombinante (Figura 2). Acordaron, por ejemplo, que fuera una bacteria específica (E. coli cepa K12) la utilizada en experimentos de DNA recombinante. Se trata de una cepa no patógena, genéticamente modificada para que no pueda colonizar el tracto digestivo humano ni sobrevivir fuera del laboratorio y, tras más de 40 años trabajando con ella, podemos decir que estas medidas fueron totalmente efectivas.
Los participantes en la Conferencia de Asilomar también se esforzaron por llevar la ciencia al dominio público. Según los organizadores Paul Berg y Maxine Singer, la conferencia “marcó el comienzo de una era excepcional, tanto para la ciencia como para la discusión pública de las políticas científicas”, y cumplió el importante propósito de poner fin a muchos temores sociales con respecto a los usos responsables de las metodologías del DNA recombinante.

Las pautas establecidas en la conferencia, permitieron realizar experimentos con la tecnología del DNA recombinante de una manera más regulada y con un conocimiento más profundo del proceso, e hicieron posible que, en pocos años, esta tecnología fuera considerada ya madura. En 1980, la Corte Suprema de EEUU dictaminó que los microorganismos genéticamente modificados podían ser patentados. Esto generó un entorno favorable en el ámbito industrial y académico para aprovechar la nueva capacidad científica de reorganizar la información genética creando nuevos tipos de moléculas de DNA en un tubo de ensayo.
Una de las aplicaciones de la ingeniería genética que mayor desarrollo ha experimentado es la transgénesis o creación de organismos transgénicos. La transgénesis consiste en introducir un determinado gen (denominado transgén) en un organismo de otra especie. Dado que el código genético es universal para todos los seres vivos, el organismo transgénico resultante puede expresar el gen ajeno.
La transgénesis puede usarse, por ejemplo, para producir en bacterias proteínas humanas de valor terapéutico. Para ello, el gen humano de interés debe ser insertado primeramente en un vector (típicamente una molécula circular de DNA llamada plásmido) mediante la tecnología de DNA recombinante. El plásmido recombinante que porta el gen humano, se transfiere a las bacterias, las cuales lo copian en cada división celular y lo utilizan para producir la proteína de interés. De este modo es posible obtener en muy poco tiempo un número enorme de copias del gen, y, también una gran cantidad de la proteína expresada por ese gen.
La insulina, una hormona pancreática que regula los niveles de azúcar en la sangre, fue la primera proteína humana producida en bacterias mediante técnicas de ingeniería genética (1978). Hasta ese momento, las personas diabéticas que no producían niveles adecuados de insulina debían ser tratadas con insulina aislada de cerdos. Se calcula que la empresa fabricante Eli Lilly, solo en los EEUU, necesitaba cerca de 56 millones de animales por año para satisfacer la demanda de este producto. Además del coste de producción de la insulina porcina, había otros problemas relacionados con el riesgo de infecciones y con la aparición de reacciones inmunitarias de rechazo. Todo ello promovió el desarrollo de otras formas de obtención de la insulina para uso terapéutico como, por ejemplo, obtenerla a partir de la expresión en bacterias del gen humano de la insulina.
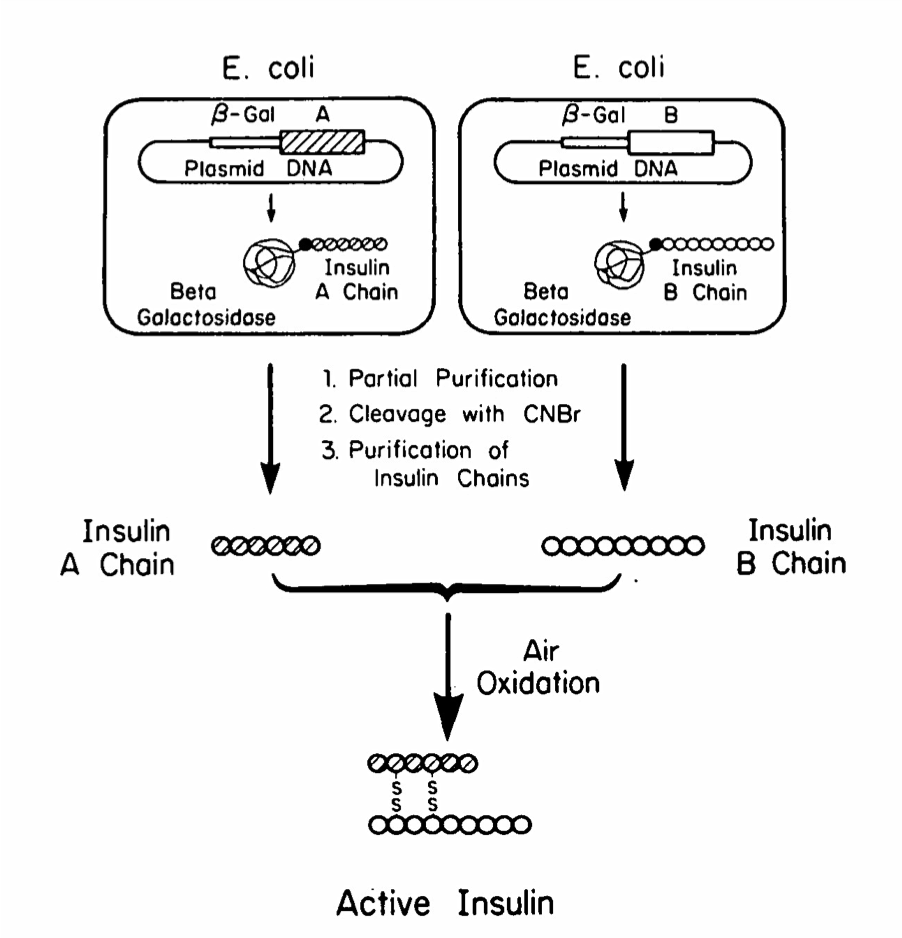
La insulina humana está formada por dos cadenas peptídicas, A y B, unidas entre sí por enlaces químicos llamados puentes disulfuro. Por ello, hubo que generar 2 moléculas de DNA recombinante (una para cada cadena). Cada una se transfirió a cultivos de bacterias independientes, se expresó y purificó cada cadena y, después, ambas se combinaron para formar la molécula de insulina completa, idéntica a la producida por el páncreas humano (Figura 3). Sin necesidad de depender de los animales, los investigadores podían ahora producir insulina recombinante en cantidades ilimitadas, libre de contaminantes y de agentes infecciosos animales. En 1982, la Insulina Humana Biosintética (BHI), desarrollada conjuntamente por Genentech y Eli Lilly se convirtió en el primer producto farmacéutico comercial sintetizado mediante tecnología del DNA recombinante, aprobado por la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA). Actualmente, más del 95% de los usuarios de insulina a nivel mundial utilizan alguna forma de insulina recombinante.
Tras este éxito, rápidamente se aprobaron diversos medicamentos sintetizados en bacterias mediante la tecnología del DNA recombinante, incluidas la hormona de crecimiento humano (en 1985), la vacuna para la hepatitis B (en 1986), el interferón (un medicamento contra el cáncer, en 1986), o la glucocerebrosidasa, (un enzima para tratar la enfermedad de Gaucher, en 1991).
La producción y comercialización de proteínas de interés terapéutico liderada por la industria biotecnológica, no es la única aplicación de la tecnología del DNA recombinante en bacterias. Esta tecnología se utiliza de forma rutinaria en investigación experimental en la mayoría de los laboratorios de biología molecular del mundo, incluidos los de nuestra Facultad. De hecho, nuestros estudiantes de los Grados de Biociencias realizan prácticas experimentales durante su formación universitaria, en las que aprenden a utilizar estas metodologías en diferentes entornos formativos y como ejemplo de sus diversas aplicaciones.
La posibilidad de generar bacterias transgénicas inició una carrera que ha llevado al desarrollo de otros organismos transgénicos, incluyendo muchas especies de animales y plantas. En próximas reseñas trataremos algunas de ellas, como la generación, uso y aplicaciones de los animales mamíferos transgénicos generados para usos científicos y/o biomédicos, y la aplicación de la tecnología del DNA recombinante en terapia humana.
Sobre los autores: Ana I. Aguirre, José Antonio Rodríguez y Ana M. Zubiaga son profesores del departamento de Genética, Antropología Física y Fisiología Animal de la Facultad de Ciencia y Tecnología, e investigadores del grupo de investigación consolidado del Gobierno Vasco Biología Molecular del Cáncer.


Manuel Garrido Díaz
Están realizando una labor más que extraordinaria es superextraordinaria
chapó para el grupo de científicos que ha formado esa UNIVERSIDAD