50 años modificando genes (en seres humanos)
La Facultad de Ciencias de Bilbao comenzó su andadura en el curso 1968/69. 50 años después la Facultad de Ciencia y Tecnología de la UPV/EHU celebra dicho acontecimiento dando a conocer el impacto que la Facultad ha tenido en nuestra sociedad. Publicamos en el Cuaderno de Cultura Científica y en Zientzia Kaiera una serie de artículos que narran algunas de las contribuciones más significativas realizadas a lo largo de estas cinco décadas.
En las anteriores entradas de esta serie, hemos realizado un breve resumen de la historia y de las aplicaciones del DNA recombinante en bacterias (01) y en animales (02). Prácticamente en paralelo al trabajo para insertar genes en el genoma de animales, se planteó la posibilidad de aplicar esta tecnología también a los seres humanos, especialmente en casos en los que la alteración de un gen provoca una deficiencia en la proteína correspondiente y la aparición de alguna patología severa. Talasemia, fibrosis quística, distrofia muscular de Duchenne o hemofilia son solo algunos ejemplos de las más de 6.000 patologías, que están causadas por errores en un gen determinado. Desde los años 90 se han desarrollado metodologías basadas en el DNA recombinante para tratar algunas de estas dolencias. Este tipo de intervención, denominada terapia génica, consiste en modificar el genoma de un virus de manera que porte una versión correcta de un gen humano (gen terapéutico) y lo inyecte en las células de los pacientes que tienen una versión defectuosa de ese gen (Figura 1). Si el tratamiento es exitoso, el gen terapéutico administrado producirá una proteína funcional que mejorará, al menos en parte, los síntomas de la enfermedad.
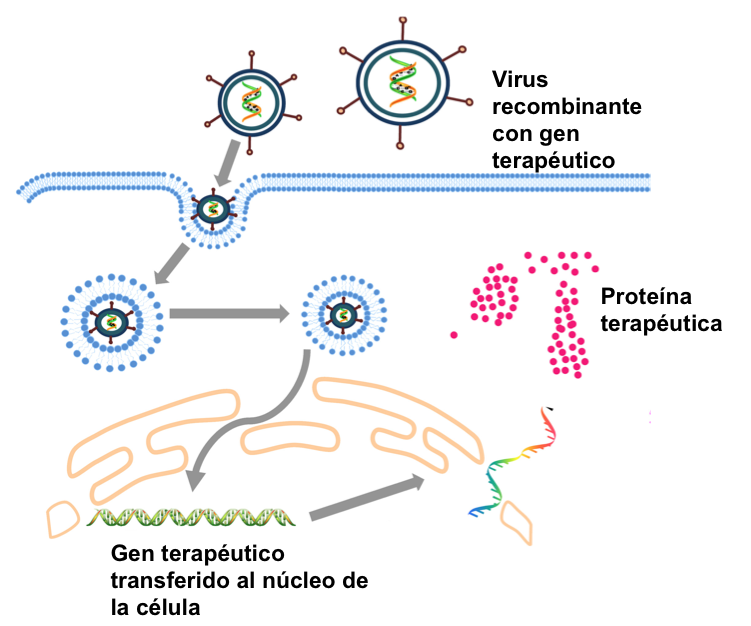
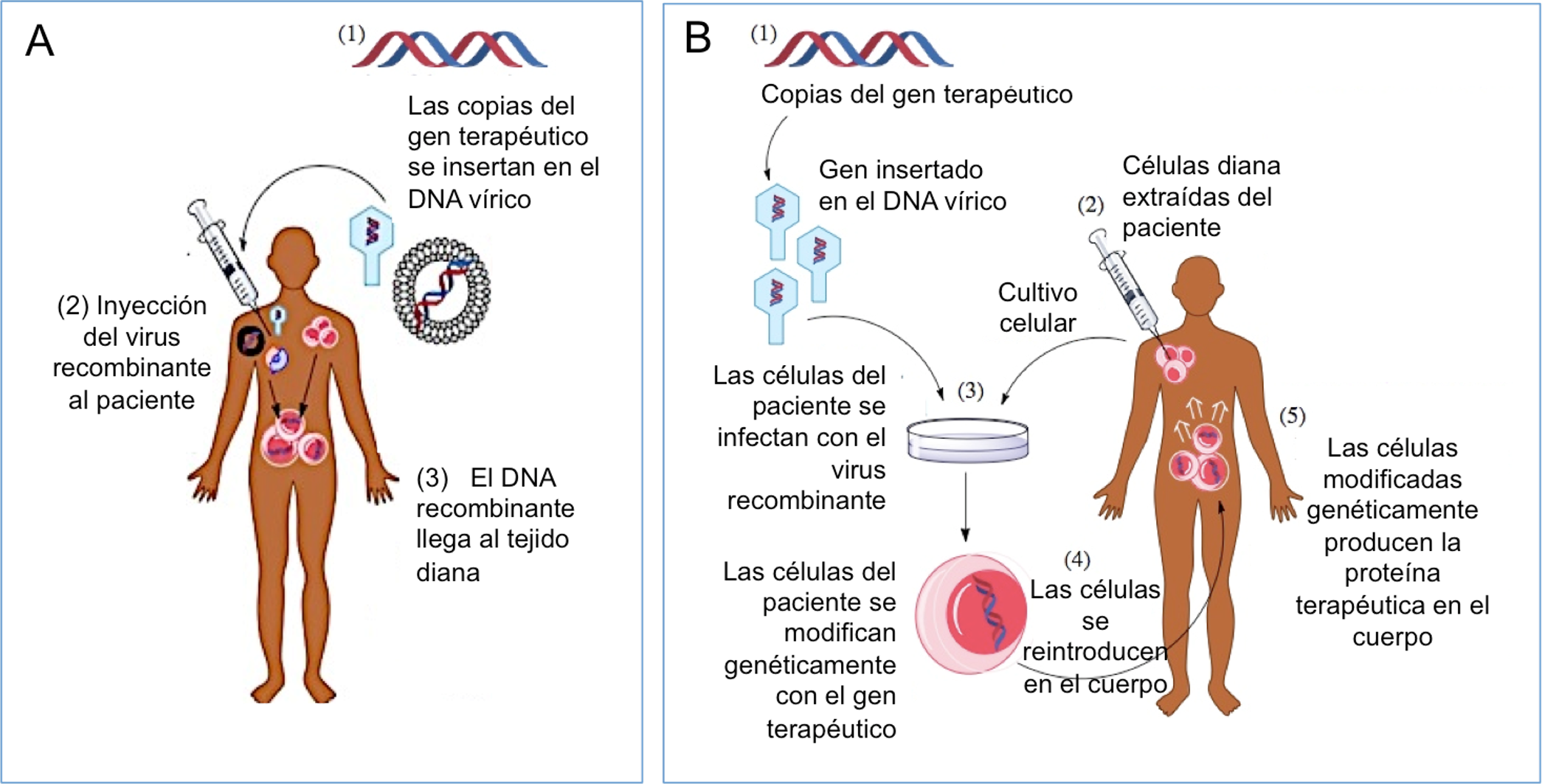
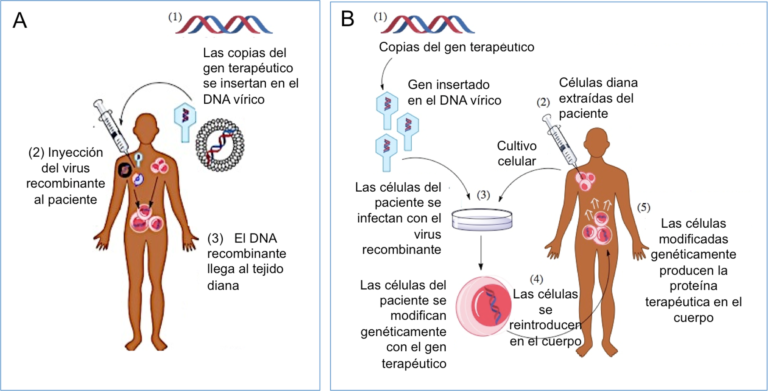
El virus recombinante que porta el gen terapéutico se puede inyectar en el paciente vía intravenosa, o en un tejido específico (terapia génica in vivo, Figura 2A). También es posible extraer células del paciente, exponerlas al virus recombinante en el laboratorio y posteriormente re-inyectar las células modificadas en el paciente (terapia génica ex vivo, Figura 2B).
A pesar de sus posibilidades, hasta hace muy poco tiempo la terapia génica ha producido más decepciones que éxitos. El primer ensayo clínico de terapia génica se realizó en 1990: una niña de cuatro años con una forma severa de inmunodeficiencia genética fue tratada en los Institutos Nacionales de la Salud de EEUU. Los investigadores extrajeron sus glóbulos blancos, insertaron en ellos copias normales del gen defectuoso y re-inyectaron las células corregidas en su cuerpo. Este ensayo se consideró exitoso porque mejoró en gran medida la salud y el bienestar de la niña tratada. Sin embargo, junto con la terapia génica, la paciente continuó recibiendo su terapia farmacológica tradicional, lo cual hizo difícil determinar la verdadera efectividad de la terapia génica por sí sola.
Esos prometedores primeros resultados se vieron truncados en 1999 por la trágica muerte de un paciente de 18 años, Jesse Gelsinger, en un ensayo clínico de terapia génica. Jesse, que presentaba una enfermedad hepática no severa, murió porque el virus utilizado para transportar el gen funcional activó su sistema inmunológico y provocó un fallo multi-orgánico. Poco después, la aplicación de un procedimiento de terapia génica volvió a generar alarma por un nuevo problema: el desarrollo de leucemia en varios niños que habían participado años antes en un ensayo de terapia génica para corregir una inmunodeficiencia genética que padecían. Se comprobó que, en estos niños, la inserción del gen terapéutico había causado la activación permanente de otro gen cercano, el cual indujo la leucemia. Este ensayo y otros que estaban en marcha en aquél momento tuvieron que interrumpirse y muchos de ellos quedaron definitivamente abandonados.
Actualmente, los procedimientos de terapia génica han superado muchos de estos problemas iniciales, gracias al desarrollo de virus más eficaces que generalmente no integran el gen terapéutico en el genoma de las células humanas, y que, además, no activan el sistema inmunológico del paciente. Tanto es así, que ahora mismo hay en marcha ensayos clínicos de terapia génica para unas 50 enfermedades diferentes, con algunos resultados muy esperanzadores.
En los últimos 30 años, en todo el mundo, se han llevado a cabo unos 3.000 ensayos clínicos de terapia génica, de los que casi 500 se han realizado entre los años 2017 y 2018. A pesar de este elevado número, solo tres tratamientos de terapia génica han sido aprobados por las agencias del medicamento estadounidenses o europeas y se pueden encontrar actualmente en el mercado: Strimbelis, para la inmunodeficiencia congénita a la que nos hemos referido anteriormente, Luxturna, para la amaurosis congénita de Leber (un tipo de distrofia genética de la retina) y, más recientemente, Zolgensma, para niños de menos de 2 años con atrofia muscular espinal
La situación actual de uno de estos tratamientos ilustra uno de los problemas adicionales de este tipo de terapia: su elevado coste económico. Cuando en 2016 las autoridades europeas aprobaron Strimbelis, el tratamiento tenía un precio de unos 600.000€ anuales y entre 2017 y 2018 solo 7 pacientes habían utilizado esta terapia en todo el mundo. El elevado coste y la escasa demanda pueden llevar, de hecho, a la inviabilidad comercial de estos tratamientos. Es el caso de Glybera, un tratamiento de terapia génica para tratar una rara deficiencia genética de lipasa que puede causar pancreatitis grave. Glybera, denominado coloquialmente «el fármaco del millón de dólares» debido a su coste, fue aprobado en 2012. En 2017 la empresa dejó de vender Glybera debido a su escasa demanda (solo 31 personas han recibido Glybera en todo el mundo).
Paralelamente al uso de la terapia génica para el tratamiento de enfermedades monogénicas, se han desarrollado aplicaciones de esta tecnología al tratamiento de algunos tipos de cáncer. Este es el caso de las denominadas terapias CAR-T, diseñadas para que sea el sistema inmune del paciente el que combata el cáncer: se trata de extraer de los pacientes un tipo de linfocitos (las células T), para modificarlos genéticamente en el laboratorio de forma que, tras re-introducirlos, detecten y destruyan las células cancerosas que hay en el paciente. Aunque este tipo de terapia produce resultados clínicos bastante variables, algunas personas con cánceres de origen sanguíneo han tenido recuperaciones llamativas y permanecen en remisión meses o años después del ensayo. Actualmente, las autoridades norteamericanas han aprobado dos tratamientos basados en esta estrategia: Yescarta (para un tipo de linfoma de las células B) y Kymriah (para la leucemia linfoblástica aguda). Se espera que en un futuro relativamente próximo esta tecnología sea también aplicable a tumores sólidos.
Sin duda, son aún numerosos los desafíos técnicos que deben abordarse para conseguir que la terapia génica sea una alternativa práctica, rutinaria, económica, segura y efectiva para tratar enfermedades. Afortunadamente, el desarrollo de las técnicas de edición genética, como CRISPR, va a permitir avanzar en todas estas cuestiones.
Tecnología CRISPR aplicada a la terapia génica
En 2012, cuando parecía que la tecnología del DNA recombinante había tocado techo, se anunció el desarrollo de una nueva metodología que permite editar genes, denominada CRISPR. Mediante esta metodología, un gen alterado puede ser eliminado o corregido de forma directa y sin necesidad de utilizar virus intermediarios. Para detalles sobre la técnica CRISPR, puede consultarse el artículo 2 de esta serie, en el que explicamos los elementos que son necesarios para su aplicación, así como sus ventajas e inconvenientes.
La tecnología CRISPR, permite realizar de una manera mucho más eficaz, rápida y económica muchas de las aplicaciones que hasta hace poco se llevaban a cabo mediante la tecnología del DNA recombinante, incluida la terapia génica. .
Actualmente se están llevando a cabo múltiples ensayos clínicos basados en CRISPR para tratar diversos tipos de cáncer. En China hay ensayos que incluyen pacientes de cáncer de esófago, pulmón, vejiga, cérvix o próstata. mientras que en EEUU y Europa se están desarrollando ensayos para tratar pacientes con melanoma, sarcoma o mieloma múltiple. También se han iniciado, o están a punto de hacerlo, ensayos clínicos basados en CRISPR para enfermedades monogénicas como beta talasemia, anemia falciforme, hemofília A, amaurosis congénita de Leber, fibrosis quística, distrofia muscular de Duchenne o Huntington.
La tecnología CRISPR está dando lugar a un sinfín de aplicaciones en el ámbito Biosanitario, no solo para el tratamiento de enfermedades, sino también para el desarrollo de estrategias indirectas de salud, como la creación de mosquitos resistentes al parásito responsable de la malaria, de moléculas que producen el “suicidio” de patógenos, de plantas resistentes a virus, hongos o insectos, o para la elaboración de alimentos menos alergénicos, entre otras.
No cabe duda que estamos asistiendo a los inicios de la aplicación de esta potente metodología, en la que hay depositadas grandes expectativas en el ámbito científico, médico e industrial, y que muy probablemente veremos crecer de manera insospechada en los próximos años.
Cuestiones éticas en terapia génica
El auge de la metodología CRISPR obliga a la sociedad a plantearse cuestiones éticas y a tomar decisiones sobre qué aplicaciones deberían ser desarrolladas y cuáles no. Algunas de estas cuestiones ya se plantearon y discutieron en relación con la tecnología del DNA recombinante. Otras, sin duda, irán apareciendo conforme la tecnología se desarrolle y la imaginación humana proponga nuevas aplicaciones.
Una de las cuestiones que más debate suscitó inicialmente en terapia génica, y que ahora vuelve a estar de actualidad con el desarrollo de la tecnología CRISPR, es la posibilidad de intervenir sobre el genoma de embriones humanos. El aspecto más controvertido de esta intervención es que las modificaciones introducidas podrían afectar a las células de la línea germinal (óvulos y células espermáticas) y, por tanto, transmitirse a generaciones futuras.
A priori, la terapia génica sobre embriones humanos podría tener un objetivo de carácter terapéutico (el tratamiento de alguna patología), o bien el de “mejora” del individuo. Aunque por razones diferentes, ambas cuestiones son controvertidas. Ciertamente, si la intervención se ha realizado porque existe un trastorno genético importante, cabría pensar que esta modificación sería también beneficiosa para los descendientes; sin embargo, podría afectar al desarrollo del feto o tener efectos secundarios a largo plazo que aún se desconocen. Además, dado que las personas que se verían afectadas por la modificación (el embrión y sus descendientes) aún no han nacido, no tendrían derecho a elegir si desean, o no, recibir el tratamiento. Todo ello ha llevado a que numerosos países hayan desarrollado directrices para evitar cambios en el genoma que puedan afectar a la descendencia y tanto EEUU como la Unión Europea han acordado no utilizar fondos públicos para estos procedimientos. Por otra parte, existe un amplio consenso internacional en considerar éticamente inadecuada la aplicación de estas metodologías para la mejora de rasgos físicos o psicológicos. Además de los motivos citados en el contexto de los tratamientos terapéuticos, existen poderosas razones que desaconsejan el uso de la terapia génica para la “mejora” de los individuos, entre otras, el hecho de que se podría producir un impacto negativo en lo que la sociedad considera «normal», lo cual podría derivar en una mayor discriminación hacia las personas con rasgos «indeseables».
A pesar de que estas cuestiones ya fueron debatidas hace años, la posibilidad técnica de editar genomas mediante CRISPR ha activado nuevamente el debate. Tanto es así, que en diciembre de 2015 se organizó una primera cumbre internacional para deliberar sobre los aspectos científicos, éticos, legales y sociales de la edición génica en humanos. En esa cumbre se pusieron de manifiesto potenciales problemas derivados de la aplicación de la tecnología CRISPR a la línea germinal. Entre ellos, el riesgo de resultados indeseados por una edición incorrecta o incompleta del genoma, la dificultad para eliminar las modificaciones una vez introducidas, así como para predecir las implicaciones futuras de tales modificaciones en sus portadores y en la población humana en general. En la cumbre de 2015 se concluyó que sería “irresponsable” proceder a cualquier uso clínico de CRISPR para la edición génica en embriones y se acordó abordar un debate internacional continuo para valorar los potenciales beneficios y riesgos de esta tecnología y realizar una supervisión continuada de su desarrollo.
A pesar de estas recomendaciones, unos días antes de iniciarse la segunda cumbre internacional sobre edición genómica en humanos a finales de 2018, el investigador chino Jiankui He dio a conocer el nacimiento de dos gemelas a partir de embriones sometidos a un proceso de edición génica para eliminar el gen CCR5. Este gen codifica una proteína que utiliza el virus VIH para introducirse en las células humanas y, debido a esta modificación, estas niñas serán posiblemente resistentes a la infección por este virus. Como no podía ser de otra manera, el procedimiento llevado a cabo por el Dr. He fue el centro de interés de la cumbre, en la que se señaló que «incluso si se verifican las modificaciones genéticas realizadas, el procedimiento fue irresponsable y no cumplió con las normas internacionales».
La actuación del Dr. He ha sido duramente criticada por la inmensa mayoría de los científicos y de los gobiernos, incluido el chino, y recientemente declarada ilegal. El rechazo generado ha inducido algunos cambios a nivel internacional. Así, el gobierno chino aplica ahora regulaciones más estrictas para experimentos que utilizan la edición de genes y cerca de 30 naciones disponen ya de medidas legislativas que prohíben la edición de la línea germinal humana. Este 2019, la UNESCO, junto con 18 científicos de primera línea procedentes de 7 países, han llamado a una moratoria global que prohíba cualquier ensayo clínico de la edición en línea germinal humana (ya sea en embriones, en óvulos o en esperma). En cualquier caso, el progreso vertiginoso de la tecnología de la edición génica en los últimos tres años y las discusiones generadas sugieren que es hora de definir un camino riguroso y responsable hacia tales ensayos.

Sobre los autores: Ana I. Aguirre, José Antonio Rodríguez y Ana M. Zubiaga son profesores del departamento de Genética, Antropología Física y Fisiología Animal de la Facultad de Ciencia y Tecnología, e investigadores del grupo de investigación consolidado del Gobierno Vasco Biología Molecular del Cáncer.

Lo Mejor de la Semana (11 – 17 de agosto) | Hablando de Ciencia
[…] 50 años modificando genes (en seres humanos). Los avances gracias a técnicas como CRISPR son evidentes, aunque todavía quedan muchos desafíos por superar hasta conseguir que la terapia genética sea una alternativa real para tratar enfermedades. […]
Naukas Bilbao 2022: ‘Hackers’ están diseñando los próximos fármacos — Cuaderno de Cultura Científica
[…] 50 años modificando genes (en seres humanos)Una infección vírica puede activar la aparición de diabetes tipo I […]