Los nuevos ‘elementos’ de las series radiactivas

El descubrimiento de que existían varias series radiactivas, cada una de las cuales contiene sustancias aparentemente nuevas, creó un problema grave. En 1910, todavía había algunos espacios vacíos en la tabla periódica de los elementos, pero no había suficientes espacios para las muchas sustancias nuevas que aparentemente pareceían surgir en las desintegraciones. La tabla periódica es una forma de presentar los elementos según sus propiedades químicas y, si no podía incluir los “elementos radiactivos”, tendría que ser revisada, quizás de alguna manera drástica y fundamental. Era un problema no menor.
La clave para la solución del rompecabezas radica en la observación de que algunos de las sustancias que se acababan de descubrir como miembros de una serie radiactiva tienen propiedades químicas idénticas a las de los elementos conocidos, aunque algunas de sus propiedades físicas sí son diferentes.
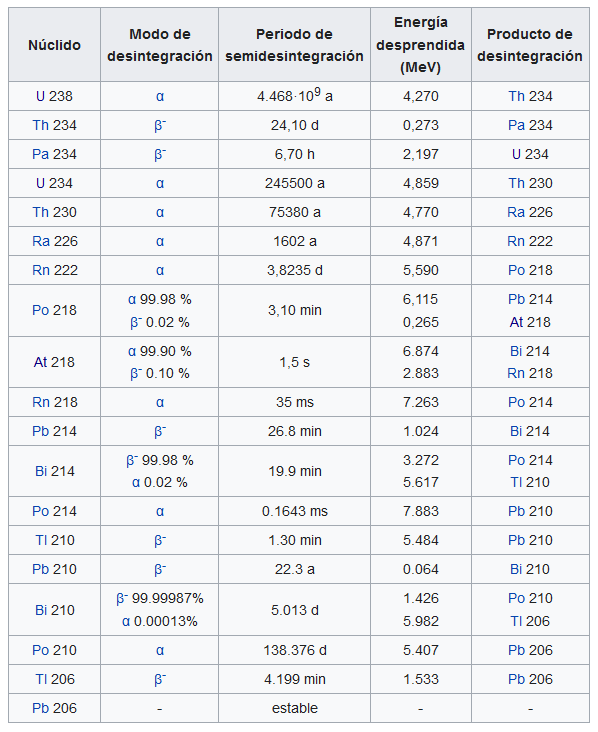
Por ejemplo, se descubrió que lo que entonces se llamaba Uranio II, “bisnieto” del Uranio I, tenía las mismas propiedades químicas que el propio Uranio I. Cuando se mezclaban, no se podían separar por medios químicos. Ningún químico ha detectado, mediante análisis químico, ninguna diferencia entre estas dos sustancias [1]. Pero las dos sustancias, ahora conocidas como uranio-238 y uranio-234, difieren entre sí en ciertas propiedades físicas. Como vemos en la tabla, el uranio-238 y el U-234 tienen periodos de semidesintegración bastante diferentes: 4,468·109 años y 2,455·105 años, respectivamente. Si nos fijamos en los modos de desintegración, la masa de un átomo de uranio-234 debe ser menor que la de un átomo de uranio-238 en la masa de una partícula alfa y dos partículas beta.
Otro par de sustancias radiactivas que se descubrieron en la época, llamadas entonces radio B y radio G, tenían las mismas propiedades químicas que el plomo; cuando se mezclan con plomo, no se pueden separar de él por medios químicos. Estas sustancias ahora se conocen como plomo-214 y plomo-206, respectivamente. El plomo 214 es radiactivo y el plomo 206 es estable. La tabla indica que los átomos deben diferir entre sí en masa el equivalente a dos partículas alfa y cinco partículas beta. Hay muchos otros ejemplos de este tipo de diferencias físicas entre dos o más sustancias radiactivas con el mismo comportamiento químico.
Soddy sugirió una solución que cambió nuestra visión sobre la naturaleza de la materia y la relación de los elementos en la tabla periódica. Propuso que un elemento químico podría considerarse como una sustancia pura sólo en el sentido de que todos sus átomos tienen las mismas propiedades químicas; es decir, un elemento químico puede ser en realidad una mezcla de átomos con diferente comportamiento radiactivo y diferentes masas atómicas, pero todos con las mismas propiedades químicas. Había surgido el concepto de isótopo.
Notas:
[1] Otra cosa ocurre en los elementos muy ligeros, donde diferencias pequeñas en términos absolutos son muy importantes en términos relativos. Pero eso fue muy posterior.
Sobre el autor: César Tomé López es divulgador científico y editor de Mapping Ignorance

El concepto de isótopo — Cuaderno de Cultura Científica
[…] idea de que un elemento químico puede ser en realidad una mezcla de átomos con diferente comportamiento radiac… y diferentes masas atómicas, pero todos con las mismas propiedades químicas, significaba que […]