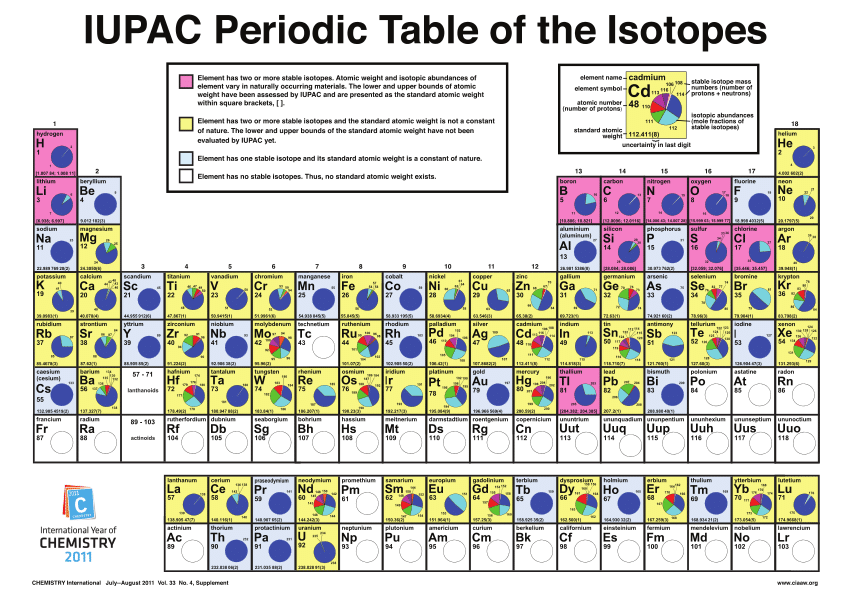
La idea de que un elemento químico puede ser en realidad una mezcla de átomos con diferente comportamiento radiactivo y diferentes masas atómicas, pero todos con las mismas propiedades químicas, significaba que habría que cambiar uno de los postulados básicos de la teoría atómica de Dalton, a saber, el postulado de que los átomos de un elemento puro son iguales en todos los aspectos.
Según Soddy, los átomos de un elemento dado son idénticos solo en las propiedades químicas [1]. Las distintas especies de átomos físicamente diferentes que componen un elemento en concreto ocupan el mismo lugar en la tabla periódica, es decir, tienen el mismo número atómico Z. Por eso, Soddy los llamó isótopos del elemento, del griego mismo-lugar, en referencia a que ocupan el mismo lugar en la tabla periódica.
Así, el uranio-238 (238U) y el uranio-234 (234U) son isótopos del uranio (92U); el plomo-214 (214Pb) y el plomo-206 (206Pb) son isótopos del plomo (82Pb). Son químicamente iguales; ocupan el mismo lugar en la tabla periódica y tienen el mismo número atómico Z, que se suele escribir como subíndice. Pero son físicamente diferentes, porque tienen diferentes masas atómicas A, que se suele escribir como superíndice en unidades de masa atómica [2].
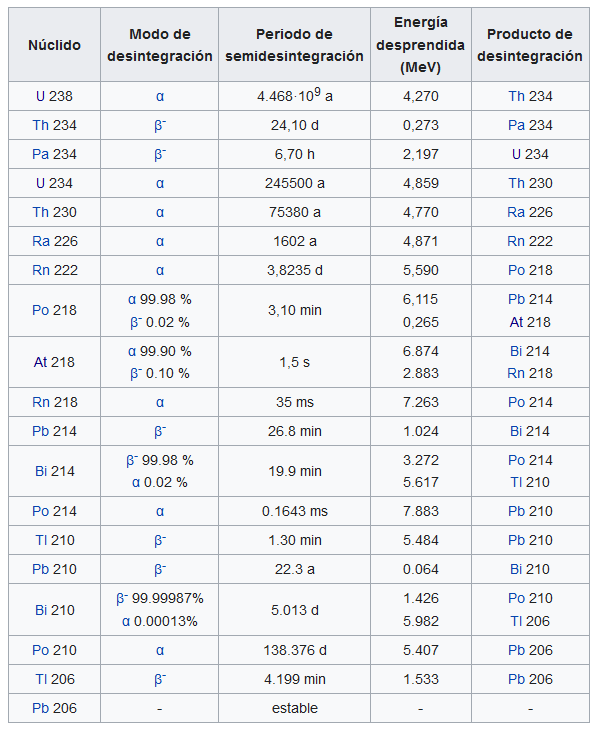
Con esta idea en mente, el análisis químico pronto demostró que las muchas especies de átomos radiactivos de las series radiactivas eran isótopos de uno u otro de los últimos 11 elementos naturales de la tabla periódica, desde el plomo (Z = 82) hasta el uranio (Z = 92). Por ejemplo, se demostró que el segundo y el quinto miembro de la serie del uranio (ver la tabla) eran isótopos del torio, con Z = 90; los miembros 8, 13 y 17 resultaron ser isótopos del polonio (Z = 84). Los antiguos nombres y símbolos dados a los miembros de las series radiactivas tras su descubrimiento se sustituyeron para representar tanto la similitud química como la diferencia física entre isótopos [3].
Es importante recalcar que al escribir el símbolo de un nucleido [2], la masa atómica siempre se da como un número natural positivo (por ejemplo, U-238); pero la consulta de cualquier tabla periódica nos dará un valor de la masa atómica de un elemento que es un número racional (para el uranio, 238.02891). Esto se debe a que la masa atómica dada en la tabla periódica se refiere a la masa del elemento en su estado natural, que es una mezcla de los diversos isótopos naturales del elemento, con sus respectivos electrones. La masa atómica del elemento natural es por tanto un promedio de las masas atómicas de los isótopos individuales, ponderadas según su abundancia en relación con las de los otros isótopos.
Notas:
[1] Esto no es del todo cierto en los elementos más ligeros, pero se puede aceptar como regla general.
[2] Cualquier especie de átomo, llamada nucleido, se representa como, por ejemplo, 23490Th y 23090Th para dos de los isótopos del torio. El subíndice (90 en ambos casos para el torio) es el número atómico Z, el número que asigna el lugar en la tabla periódica; el superíndice (234 o 230) es el número de masa A, la masa atómica aproximada en unidades de masa atómica.
[3] Por ejemplo, el uranio X1 y el ionio pasaron a ser torio-234 y torio-230.
Sobre el autor: César Tomé López es divulgador científico y editor de Mapping Ignorance
Las reglas de desplazamiento radiactivo — Cuaderno de Cultura Científica
[…] El concepto de isótopo fue un avance muy significativo en la comprensión de la radiactividad. Pero aun estaban sobre la mesa dos cuestiones fundamentales, a saber, ¿cómo se producen los cambios en la naturaleza química cuando un átomo sufre una desintegración radiactiva? y ¿qué determina si el número atómico Z aumenta o disminuye en una transformación radiactiva dada? […]
Datación radiométrica — Cuaderno de Cultura Científica
[…] isótopo minoritario del carbono conocido como carbono-14 se utiliza a menudo para este propósito. Este […]
Rayos X y neutrones para descubrir el origen del agua en la Tierra — Cuaderno de Cultura Científica
[…] poder responder a estas preguntas, los científicos están intentando conocer con precisión las ratios isotópicas de los distintos elementos, ya que pequeñas variaciones en estas proporciones podrían significar […]
Isótopos y variabilidad climática — Cuaderno de Cultura Científica
[…] en la naturaleza y así ocurre con varios elementos en la naturaleza, a los que se denominan isótopo: del griego isos = igual, y topos = lugar; debido a que su número atómico es el mismo (igual […]
La alimentación durante la Alta Edad Media ibérica — Cuaderno de Cultura Científica
[…] basada en la comparación de los patrones alimenticios de tres regiones a partir de análisis de isótopos estables de carbono y nitrógeno sobre colágeno óseo. Para ello se tomaron muestras en diez […]
El cerio y la evolución química del universo
[…] núcleo de número mágico. La mayor parte del cerio del Universo (89%) existe como cerio-140, un isótopo del elemento que contiene 58 protones y un número mágico de 82 neutrones. Los núcleos de […]