El equipo de investigación BIOMICS de la UPV/EHU ha investigado las variaciones que se aprecian en las moléculas de ARN —que se encargan de transferir la información del genoma a las proteínas— entre las personas que padecen cáncer de mama y entre las que no lo padecen, así como los cambios que se advierten en función de cada subtipo de cáncer. Los resultados del estudio muestran que la metilación del ARN en los tejidos tumorales es menor que en los tejidos sanos. Además, se observan diferencias según el tipo de cáncer de mama.
El cáncer es una enfermedad que depende de muchos factores y, además, hay muchos tipos de cánceres. Es importante identificar cuáles son los factores de riesgo de padecer cáncer: para ello, se analizan los grupos de población y se comparan las características de quienes padecen cáncer con las de quienes no lo padecen; de ese modo, se ve si las personas que lo padecen tienen una mayor o menor probabilidad de contar con una determinada característica.
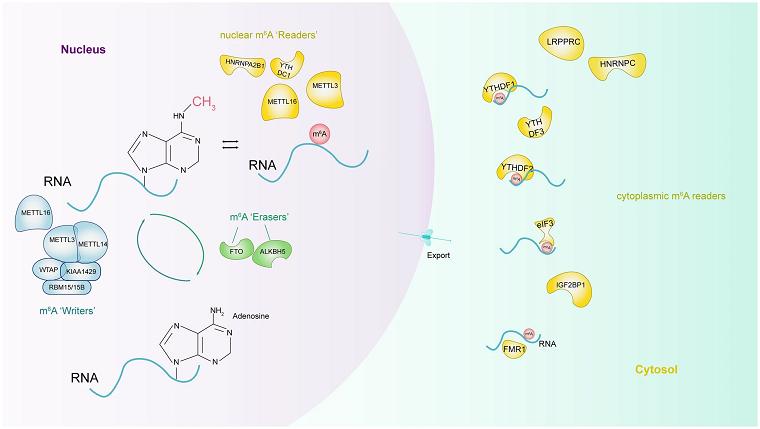
El equipo ha analizado uno de los cambios más frecuentes que se produce en el ARN mensajero: la metilación (adición de un grupo formado por un carbono y tres hidrógenos, en una posición determinada de la molécula de ARN). Un determinado tipo de metilación da como resultado la N6-metiladenosina (m6A). Numerosos estudios han demostrado que la m6A participa en la regulación de la mayoría de los procesos del metabolismo del ARN. Pero aún no se conoce el impacto de este cambio en la regulación de la expresión génica, su función en los procesos celulares y su posible influencia en el desarrollo y avance de enfermedades como, por ejemplo, el cáncer de mama.
Los investigadores han medido la cantidad de m6A presente en el cáncer de mama con el fin de encontrar nuevas dianas terapéuticas en el futuro. “Las metilaciones de m6A son muy frecuentes, ya que se producen para regular la función del ARN. Pero en el cáncer dicha regulación se pierde, y hemos querido observar el papel que juega la metilación del ARN en ese trastorno”, explica Felix Olasagasti, investigador del grupo BIOMICs.
Los resultados muestran que “el porcentaje global de metilación del ARN en los tejidos tumorales es menor que en los tejidos sanos, y la diferencia es significativa”, señala Olasagasti. Además, este es el primer estudio que describe el perfil de metilación de m6A en los diferentes subtipos de cáncer de mama: “Hemos visto que la diferencia detectada en la metilación de las células cancerosas aparece con distinto perfil en función de cada tipo de cáncer de mama. Los cánceres de mama se clasifican según determinadas características. Nosotros hemos visto que, además de las características que se utilizan para dicha clasificación, también hay diferencias en la metilación del ARN en los distintos subtipos de cánceres”.
El investigador subraya la importancia de este hallazgo: “Cuanto mejor conozcamos cómo es o cómo debemos caracterizar cada subtipo de cáncer, más posibilidades tendremos de obtener un tratamiento para combatirlo”. En cualquier caso, el investigador señala que aún queda mucho camino por recorrer. “De este estudio se deduce que la alteración de la metilación podría afectar a las proteínas derivadas de dichos ARN, lo que podría afectar finalmente al carácter canceroso de la célula”. Esa es la hipótesis que manejan los investigadores.
En el estudio han empleado una técnica de secuenciación masiva. “Hemos conseguido un montón de datos. Debemos analizarlos con más detalle para ver en qué genes se producen los cambios. Una vez bien determinados los genes, el siguiente paso sería observar en qué medida afecta eso a las proteínas y ver luego el efecto que eso puede tener. Viendo que el porcentaje de metilación es menor en las células cancerosas, podríamos pensar que aumentar dicho porcentaje podría ayudar a regenerar esas células”. Según Olasagasti, cada uno de esos pasos constituiría un proyecto de investigación.
Para saber más:
¿De dónde viene el cáncer y por qué no ha desaparecido con la evolución?
El cáncer en la nueva era genómica
Referencia:
Tamara Kleinbielen, Felix Olasagasti, Daniel Azcarate, Elena Beristain, Amparo Viguri-Díaz, Isabel Guerra-Merino, África García-Orad, Marian Martínez de Pancorbo (2022) In silico identification and in vitro expression analysis of breast cancer-related m6A-SNPs Epigenetics doi: 10.1080/15592294.2022.2111137
Edición realizada por César Tomé López a partir de materiales suministrados por UPV/EHU Komunikazioa