Terapias ARN, un presente con mucho futuro
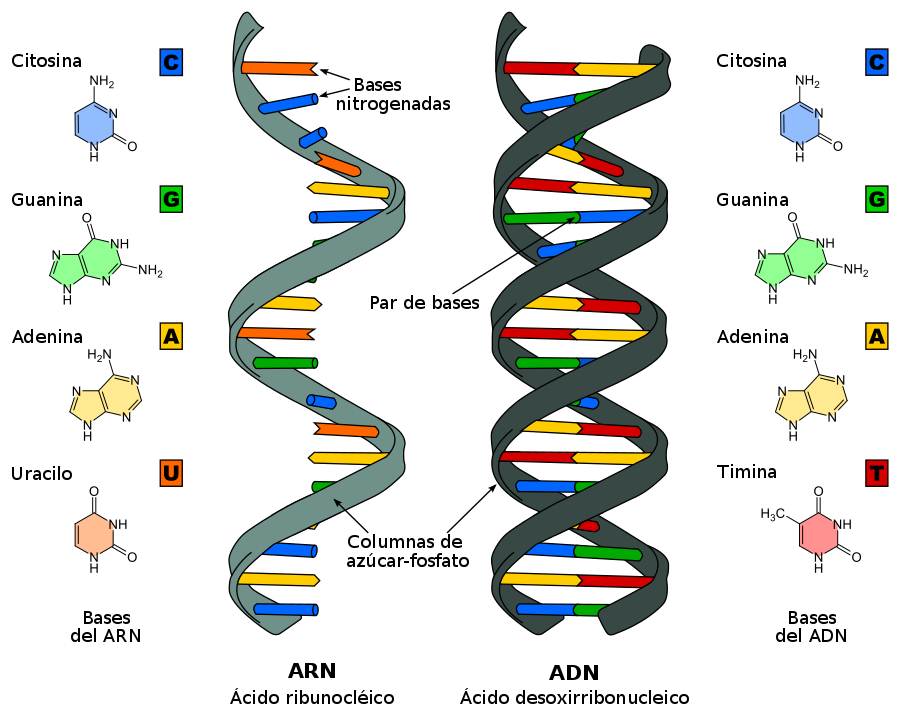
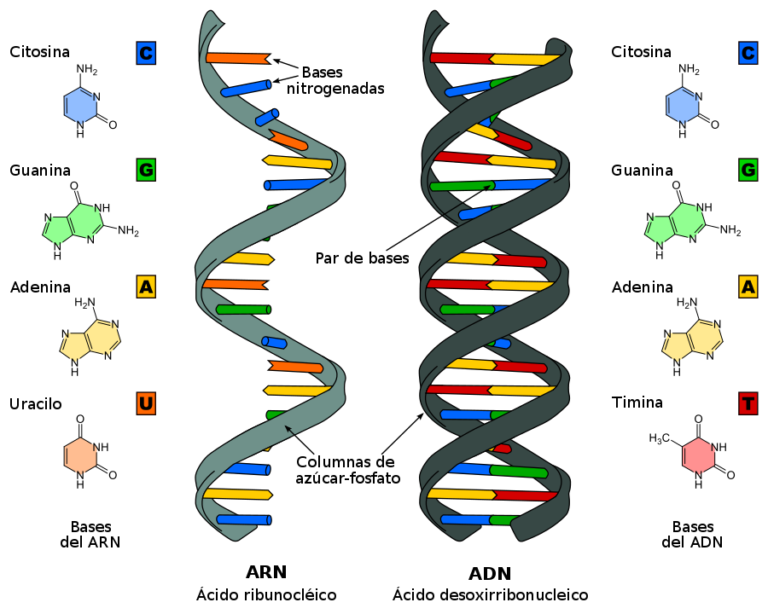
La expresión “llevar algo en el ADN” es un reflejo de cuán extendido está el conocimiento sobre el ADN o ácido desoxirribonucleico en la sociedad. Sin embargo, el ARN o ácido ribonucleico es mucho menos conocido. Hasta hace poco se le conocía como una ‘copia’ del ADN que llevaba información para sintetizar proteínas, pero ahora sabemos que hay muchos tipos de ARN como el mensajero (ARNm), los de interferencia siARN (del inglés short interfering), los microARNs (miARN) y muchos otros que presentan diferentes funciones relacionadas con la síntesis de proteínas en el organismo.
Cada una de esas funciones representa una nueva diana con la que es posible interaccionar para alterar la expresión de proteínas, tanto evitando la expresión de proteínas perjudiciales como permitiendo la expresión de otras necesarias. Esa amplia gama de actividad explica que los diseños de nuevas terapias ARN tengan un elevado potencial tanto para la prevención como para el tratamiento de enfermedades muy diversas. La aplicación clínica de esas terapias se ha realizado de manera generalizada a la población debido a la pandemia de la COVID-19. La inmunización frente al coronavirus SARS-CoV-2 se ha realizado con vacunas de ácidos nucleicos, incluyendo las basadas en ARN. En ese sentido, la elevada eficacia obtenida y, sobre todo, el excelente perfil de seguridad mostrado, está fomentando el auge de nuevas terapias ARN.
Las posibilidades que ofrecen las terapias ARN han revolucionado la manera de afrontar el tratamiento de numerosas enfermedades, ofreciendo incluso nuevas opciones a aquellas para las que actualmente no hay terapias disponibles. Las enfermedades candidatas a ser tratadas mediante ARN pueden ser hereditarias (como, por ejemplo, las enfermedades de depósito lisosomal, las distrofias musculares o la fibrosis quística) o adquiridas (como el cáncer, enfermedades infecciosas, degeneración macular o enfermedades neurológicas como el Parkinson o el Alzheimer, entre otras).
Aunque la mayoría de esos nuevos medicamentos estén aún en desarrollo, además de las vacunas ARN, existen ya varios productos aprobados para el tratamiento de enfermedades poco frecuentes, como la atrofia muscular espinal o la distrofia muscular de Duchenne, pero también para otras mucho más frecuentes, como terapias para la prevención cardiovascular y manejo de las dislipemias. Se espera que en los próximos años se desarrollen muchas más terapias ARN: una nueva clase de medicamentos con grandes ventajas por ser muy específicos en su mecanismo de acción. Sin embargo, uno de los principales obstáculos para el desarrollo de esos medicamentos es la obtención de un sistema de administración eficaz y seguro, capaz de proteger el ARN terapéutico y acceder al lugar de acción, permitiendo que ejerza su efecto.
El mayor problema para la aplicación de las terapias ARN
La eficacia de las terapias ARN está condicionada por sus dificultades para superar las barreras anatómicas y extracelulares, que limitan su acceso y, por tanto, su efecto en una célula concreta. No es igual de accesible el ojo (un tejido muy bien delimitado y pequeño) o la sangre (fácilmente accesible), que el músculo (un tejido muy extenso y protegido por muchas barreras físicas) o el cerebro (protegido por la barrera hematoencefálica). Las nanopartículas lipídicas, empleadas en las vacunas COVID-19, han mostrado ser un sistema altamente seguro y eficaz para administrar esos medicamentos de forma local, y también se han utilizado para terapias ARN dirigidas al hígado. Sin embargo, es necesario el desarrollo de nuevos sistemas con el fin de administrar terapias que necesitan distribuirse de manera generalizada a otros tejidos (como, por ejemplo, el músculo y el tejido óseo) o llegar a órganos de difícil acceso (como el cerebro).
Recientemente se celebró en Bizkaia Aretoa el congreso internacional organizado por la UPV/EHU y DARTER COST (Acción de Cooperación Europea en Ciencia y Tecnología), que contó con la partición de 160 personas de 17 países europeos. La red de investigadoras e investigadores DARTER, liderada por Virginia Arechavala, aglutina a más de 450 investigadoras e investigadores de toda Europa con el interés común de resolver el mayor problema para la aplicación de las terapias ARN: su mala distribución dentro del organismo. Durante tres días, personal experto en diversos ámbitos (estudio de las enfermedades y posibles tejidos diana, química de esos ácidos nucleicos, terapias avanzadas, nanomedicina, y diseño y evaluación de nuevos sistemas de administración de fármacos) han compartido su conocimiento para fomentar la diseminación de resultados y la búsqueda de sinergias en investigación. Participantes en el congreso (entre quienes se encontraba personal investigador, representantes de asociaciones de pacientes y empresas) destacaron la calidad de las más de 80 presentaciones orales y 60 posters con los que se ha buscado favorecer la colaboración multidisciplinar en ese ámbito.
Para saber más:
Buscando terapias para enfermedades poco frecuentes
‘Hackers’ están diseñando los próximos fármacos
Sobre las autoras:
Mª Ángeles Solinís Aspiazu. Profesora de la Facultad de Farmacia de la Universidad del País Vasco. Investigadora del grupo PharmaNanoGene de la UPV/EHU y del IIS Bioaraba.
Ainara Vallejo Illarramendi. Investigadora permanente del Departamento de Pediatría de la Universidad del País Vasco. Jefa del grupo Neurociencias de la UPV/EHU e investigadora del IIS Biodonostia.
Olatz Villate. Investigadora del grupo Oncología Pediátrica del IIS Biocruces-Bizkaia.
Virginia Arechavala Gomeza. Investigadora Ikerbasque Professor. Jefa del grupo Terapias de Ácidos Nucleicos para Enfermedades Raras (NAT-RD), IIS Biocruces Bizkaia.