Terciana: Calentura intermitente que repite cada tercer día.
Cuartana: Calentura, casi siempre de origen palúdico, que entra con frío, de cuatro en cuatro días.
(Diccionario de la Lengua Española).
Fue el médico militar francés Alphonse Laveran, del que hablaré en otro capítulo de esta serie, quien demostró en 1880, con la ayuda de un microscopio no muy potente, que el parásito que provoca la malaria tenía, según vio en preparaciones de sangre fresca de enfermos, un cuerpo globular ciliado que, años más tarde se asignó a un protozoo del género Plasmodium. Ahora nosotros vamos a conocer en detalle al protagonista principal de las historias de la malaria.
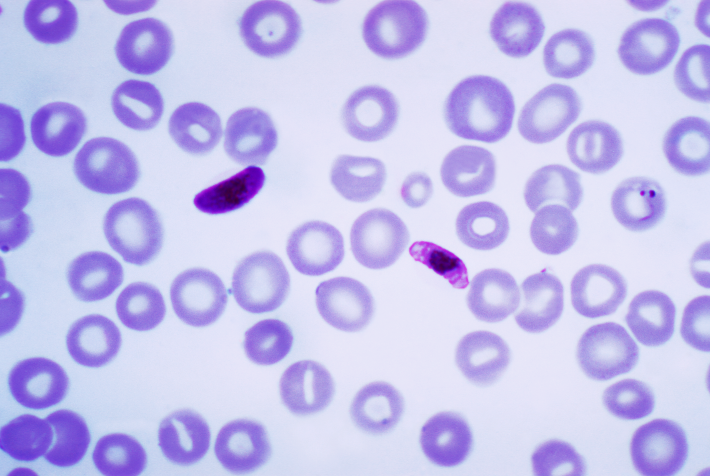
Son cuatro las especies de Plasmodium que causan la malaria en nuestra especie. El Plasmodium falciparum es la especie más letal, la más asociada a la mortalidad que provoca el parásito de la malaria. Menos letales son las otras tres especies implicadas: Plasmodium vivax, Plasmodium malariae y Plasmodium ovale.
El ciclo vital de los plasmodios tiene dos fases: una sexual en la hembra del mosquito transmisor, y otra asexual en el huésped vertebrado. Esta fase en el vertebrado tiene, a su vez, dos fases: la primera, una vez llega por la picadura del mosquito, en las células del hígado, y la segunda en los glóbulos rojos de la sangre. La descarga de los parásitos en gran cantidad desde los glóbulos rojos es la que provoca las fiebres típicas de la malaria.
Una vez que el insecto pica al vertebrado huésped, y se carga de células sexuales del parásito y, en el estómago del insecto, se unen, forman el zigoto o huevo fecundado que, a su vez, se rompe en abundantes células del protozoo llamadas esporocitos que llegan a las glándulas salivares del mosquito y, cuando éste pica, son descargados a la sangre del huésped vertebrado, y el ciclo comienza de nuevo.
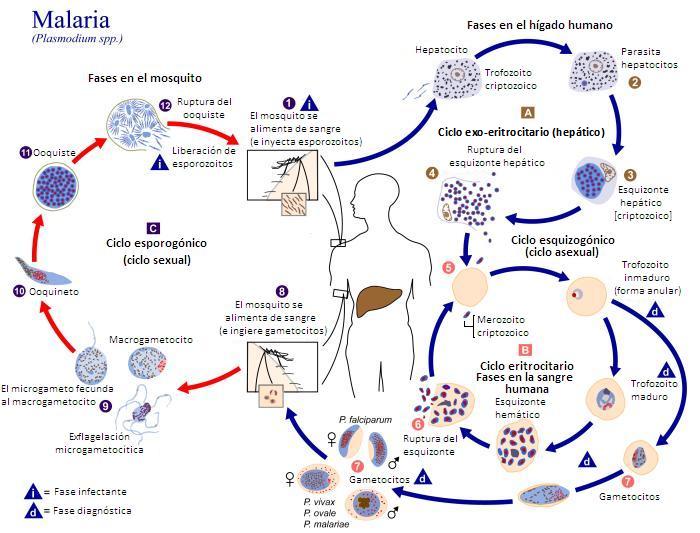
Los esporocitos atraviesan la pared del digestivo del vertebrado y llegan al hígado, en una hora más o menos, y allí se multiplican formando los merozoitos que se descargan a la sangre e invaden los glóbulos rojos. Se vuelven a dividir hasta formar más merozoitos y, finalmente, las células sexuales que, cuando pica el mosquito, llegan a su estómago, y vuelve a comenzar el ciclo.
Complicado pero así consiguen tantos parásitos el éxito evolutivo que tienen.
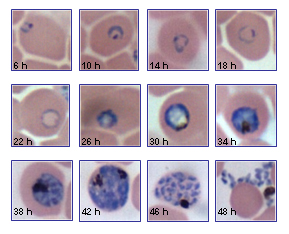
La reproducción del Plasmodium en los glóbulos rojos tarda unas 48 horas en el falciparum, vivax y ovale, y 72 horas en malariae. El ciclo de 48 horas es el que provoca las fiebres que se llaman tercianas, con un acceso un día de cada dos. Si es con falciparum, es la terciana maligna; si es con ovale o vivax, es la fiebre terciana benigna. En malariae, con el ciclo de 72 horas, aparecen la fiebre que se denomina cuartana, con un día de cada tres.
El ciclo completo del desarrollo de los protozoos en la especie humana es de 9 a 15 días en falciparum, de 12 días en vivax y ovale, y de 20 días en malariae. Los parásitos no sobreviven en el huésped más de un año, para el falciparum, o de dos años, para el vivax y el ovale. El P. malariae plantea más problemas pues puede mantenerse hasta algunas decenas de años. En conclusión, si se controlan los insectos durante tres años en un determinado enclave con malaria, el parásito desaparece. Se hizo en la década de los sesenta en Estados Unidos, Puerto Rico y otros países y se erradicó la enfermedad.
La entrada de los protozoos en los glóbulos rojos se consigue por la unión del parásito a receptores de membrana de las células de la sangre. Si no hay unión, el plasmodio no puede entrar en el glóbulo rojo y completar su ciclo de crecimiento y, por tanto, no hay ataques de fiebre en el enfermo. Es lo que ocurre en África con el vivax que no consigue entrar en los glóbulos rojos. Es una especie que no aparece en muchas zonas de África, precisamente las mismas zonas en que gran parte de la población, entre el 90% y el 100%, tiene la mutación negativa del grupo sanguíneo Duffy. En esta mutación, el receptor de membrana, una proteína que caracteriza al grupo Duffy, no se sintetiza y, por tanto, no está en la membrana de los glóbulos rojos. Y el vivax, para entrar en la célula, se une precisamente a ese receptor Duffy. Y, por ello, al faltar el receptor no puede entrar en el glóbulo rojo. Se ha propuesto que por esta causa ha desaparecido de grandes zonas de África. Está en chimpancés y gorilas, pero no en la especie humana.
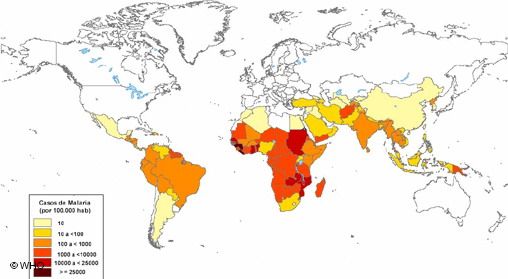
El ciclo vital del parásito en el mosquito necesita de una temperatura ambiente elevada. En el Plasmodium falciparum es de más de 26ºC, con una mínima para poder desarrollarse de 18ºC, y el ciclo dura diez días. En vivax es de 8-9 días, en ovale son 12-14 días, y en malariae es de 14-15 días. Estas especies están, por esa restricción de temperaturas, confinadas al trópico y, si aparecen en zonas más templadas, es porque el mosquito vive en interiores, climatizados por nuestra especie, con un microclima más estable y temperaturas no tan bajas como en el exterior.
Con estas limitaciones de temperatura, es indudable el impacto que puede tener el calentamiento global para un aumento del área de distribución del Plasmodium. Ya está ocurriendo en el sur y el este de África, y la epidemia de malaria en Madagascar a finales de los ochenta, a partir de 1987, en zonas de altitud y con clima más fresco que en la costa, donde la enfermedad, con pequeños focos, había desaparecido en 1960, es un buen ejemplo. En pocos años alcanzó los 25000 muertos.
El origen y la expansión del plasmodio es anterior a la especie humana. La propagación por todo el planeta tuvo, cuando ya parasitaba a nuestra especie, precisamente en la extraordinaria movilidad y adaptación a todos los entornos del Homo sapiens.
Su origen según algunos expertos, está en algún protozoo, parásito del intestino de vertebrados, que consiguió atravesar la pared del tubo digestivo y adaptarse a vivir en otros órganos y, muy importante, en la sangre del huésped. Después, en un segundo paso, encontró un huésped invertebrado en los mosquitos picadores y chupadores de sangre. Hay que recordar que mosquitos parecidos a los actuales ya existían hace unos 150 millones de años.
Las líneas más antiguas de plasmodios de la malaria están en reptiles y aves y, en una línea más reciente, aparece en mamíferos, incluyendo a primates y a nuestra especie. Algunos dicen que el paso de falciparum de aves, quizá domésticas, a Homo sapiens, es reciente, de hace entre 5000 y 10000 años. Otros autores proponen que el parásito de humanos viene del chimpancé y que el paso se puede fechar hace unos 8 millones de años, cuando aparecieron las especies que llevarían, por una parte, a los chimpancés actuales y, por otra, a la especie humana. Las pruebas directas más antiguas de la malaria en la especie humana, aún con descripciones médicas y literarias anteriores, están en las momias egipcias, desde hace unos 4000 años, y en los cadáveres de cementerios cercanos a Roma y fechados hace unos 2000 años, en la época imperial. El análisis de ADN y pruebas inmunológicas de esos cuerpos han demostrado la presencia de falciparum. Incluso la momia de Tutankamon y las de tres familiares suyos, enterrados hace unos 3500 años, dan positivo al análisis de ADN de falciparum.
Ahora empezamos a conocer el genoma de los plasmodios. Tienen 14 cromosomas. Y el estudio del ADN lleva a estudiar su evolución. Por ejemplo, algunos de los plasmodios de humanos, en los análisis genéticos, son muy parecidos a los que se encuentran en otros monos actuales y, por tanto, el paso de la malaria a humanos sería más reciente. Así, el protozoo más cercano al falciparum se encuentra en los gorilas, y el de vivax en gorilas y chimpancés.
Además, el análisis genético ha permitido detectar que hay infecciones mixtas, con más de una de las especies de plasmodios en las zonas donde se localiza más de una. Es interesante que las infecciones con vivax o con malariae reducen la gravedad de la infección con falciparum. Incluso se ha encontrado otro plasmodio, parásito del macaco, que, a veces, también parásita a la especie humana. Es el Plasmodium knowlesi.
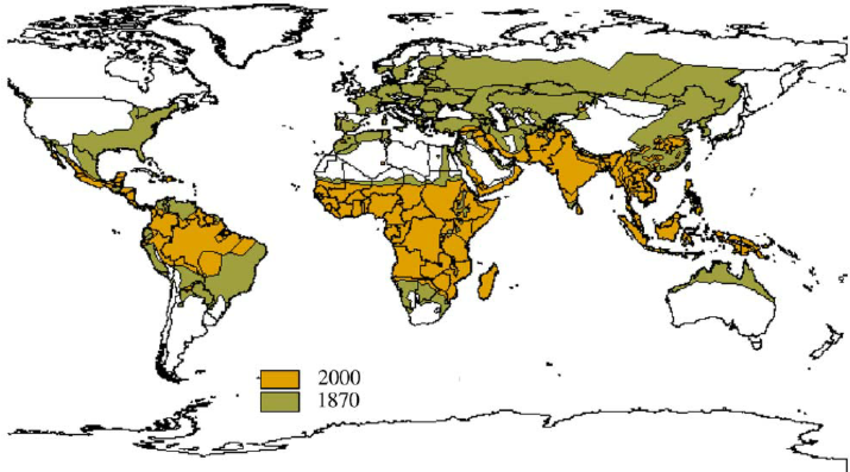
En cuanto al origen geográfico de la malaria en nuestra especie parece que se localiza en el centro y el este de África, en la región de Etiopía. Desde allí, por el valle del Nilo, llegó al Mediterráneo y, después, hacia el oeste y el norte, a Europa, y hacia el este a Oriente Medio, la India y el sudeste de Asia.
Plasmodium vivax es la especie que tiene una distribución más amplia, en el trópico, subtrópico y zonas templadas. P. falciparum es la especie más común en el trópico y subtrópicos y, rara vez, en zonas templadas. P. malariae tiene igual distribución que falciparum pero es menos común. Y P. ovale se encuentra en el África tropical y, esporádicamente, en otras zonas del planeta.
Referencias:
Bianucci, R. et al. 2007. Immunological evidence of Plasmodium falciparum infectyion in an Egyptian child mummy from the Early Dynastic Period. Journal of Archaeological Science doi: 10.106/j.jas.2007.11.019
Bray, R.S. & P.C.C. Garnham. 1982. The life-cycle of primate malaria parasites. British Medical Bulletin 38: 117-122.
Brockington, F. 1964. La salud en el mundo. EUDEBA. Buenos Aires. 403 pp.
Bruce-Chwatt, L.J. 1965. Paleogénesis and paleo-epidemiology of primate malaria. Bulletin of the WHO 32: 363-387.
Coluzzi, M. 1994. Malaria and the Afrotropical ecosystems: Impact of man-made environmental changes. Parasitologia 36: 223-227.
Earle, D.P. 1979. A history of malaria and its ironies. Transactions of the American Clinical and Climatological Association 90: 1-26.
Gentilini, M. et al. 1977. Médecine Tropicale. Flammarion-Sciences. Paris. 561 pp.
Hawas, Z. et al. 2010. Ancestry and pathology in King Tutankhemum’s family. Journal of American Medical Association 303: 638-647.
Hommel, M. 2007. Morphologie, biologie et cycle des Plasmodium parasites de l’homme. Bulletin de l’Académie nationale de médecine 191: 1235-1246.
Howes, R.E. et al. 2011. The global distribution of the Duffy blood group. Nature Communications DOI: 10.1038/ncomms1265
Laremruata, A. et al. 2013. Molecular identification of falciparum malaria and human tuberculosis co-infections in mummies from the Fayum Depression (Lower Egypt). PLOS ONE 8: e60307
Lepers, J.P.et al. 1990. Newly transmitted Plasmodium falciparum malaria in the central highland plateaux of Madagascar: assessment of clinical impact in a rural community. Bulletin of the WHO 68: 217-222.
Lu, W. Et al. 2014. African origins of the malaria parasite Plasmodium vivax. Nature Communications DOI: 10.1038/ncomms4346
Marciniak, S. et al. 2016. Plasmodium falciparum malaria in 1st-2nd century CE southern Italy. Current Biology DOI: 10.1016/j.cub.2016.10.016
Meibalan, E. & M. Marti. 2017. Biology of malaria transmission. Cold Spring Harbor Perspectives in Medicine 7: a025452
Mercereau, O. & D. Ménard. 2010. Plasmodium vivax and the Duffy antigen: A paradigm revisited. Transfusion Clinique et Biologique doi: 10.1016/j-tracli.2010.06.005
Pagès, F. 1953. Le paludisme. PUF. Paris. 113 pp.
Schlagenhauf, P. 2004. Malaria: from prehistory to present. Infectious Disease Clinics of North America 18: 189-205.
Tan, S.Y. & A. Ahana. 2009. Charles Laveran (1845-1922): Nobel laureate pioneer of malaria. Singapore Medical Journal 50: 657-658.
Sobre el autor: Eduardo Angulo es doctor en biología, profesor de biología celular de la UPV/EHU retirado y divulgador científico. Ha publicado varios libros y es autor de La biología estupenda.

Manuel López Rosas
Qué interesante observación al reportar que unos grados de diferencia de temperatura estimulan o inhiben la reproducción de «Plasmodium» y que (interpretación mía sujeta a corrección si es necesario) que lo que llamamos malaria es solo la expresión del proceso del crecimiento de la población ya dentro del organismo donde se reproduce:
«El ciclo vital del parásito en el mosquito necesita de una temperatura ambiente elevada. En el Plasmodium falciparum es de más de 26ºC, con una mínima para poder desarrollarse de 18ºC, y el ciclo dura diez días. (..) si aparecen en zonas más templadas, es porque el mosquito vive en interiores, climatizados por nuestra especie, con un microclima más estable y temperaturas no tan bajas como en el exterior.»
Eduardo Angulo
La fiebre se produce cuando el protozoo se reproduce, destruye los glóbulos rojos y se vierte al torrente sanguíneo. La respuesta del enfermo, como en muchas otras infecciones, es la defensa por subida de la temperatura, o sea, la fiebre. Y como las diferentes especies tienen tiempos de reproducción distintos, según la especie Plasmodium de que se trate, la fiebre se produce en días diferentes y, así, tenemos tercianas y cuartanas.
Jesus Mari
Hola Eduardo:
Una vez que el mosquito pica al, pongamos, humano, dices en tu artículo que: «Los esporocitos atraviesan la pared del digestivo del vertebrado y llegan al hígado, en una hora más o menos»… No entiendo lo del paso de «atravesar la pared del digestivo»… Una vez en la sangre del infectado, los esporocitos podrán acceder al hígado directamente mediante el torrente circulatorio, ¿no?
Eduardo Angulo
Cierto, aquí hay algo que tengo que repasar, parece incoherente. Ya contaré qué es lo que ocurre.
Eduardo Angulo
Error completo, un salto del estómago del mosquito al estómago de nuestra especie. Gracias por la corrección.
¿Quiere controlar la malaria? Proteja a las ranas – La Fragua
[…] malaria es una enfermedad provocada por protozoos parásitos del género Plasmodium, y es transmitida a los seres humanos por mosquitos del género Anopheles. Se da la afortunada […]
¿Quiere controlar la malaria? Proteja a las ranas
[…] malaria es una enfermedad provocada por protozoos parásitos del género Plasmodium, y es transmitida a los seres humanos por mosquitos del género Anopheles. Se da la afortunada […]