Historias de la Malaria: La vacuna
Las investigaciones para encontrar una vacuna contra la malaria comenzaron a principios del siglo XX sin mucho éxito. Una vacuna es la última, más eficaz y mejor solución en la lucha contra una enfermedad. Es un solo producto que, mejor en una que en varias dosis, protege por largo tiempo, quizá durante el resto de la vida del vacunado. La vacuna ideal debe ser sencilla en su aplicación, sin necesidades prácticas excepcionales, y que se pueda aplicar a muchas personas en pocos días. Por otra parte, desarrollar una vacuna lleva muchos años: la vacuna contra la malaria RTS,S tuvo sus primeros ensayos en 1985 y fue aprobada, con la marca Mosquirix, en 2015.
Entre 1910 y 1950 se hicieron muchos ensayos en nuestra especie, primates y aves, pero no funcionaron. Fue en 1967 cuando Ruth Nussenzweig y su grupo, de la Universidad de Nueva York, publicaron sus estudios sobre la inmunidad en ratones después de inyecciones de mosquitos irradiados con rayos X. Sin embargo, todavía en la actualidad solo existe una vacuna con licencia aunque, ya lo veremos, hay ensayos clínicos de varias incluso sobre grandes poblaciones.
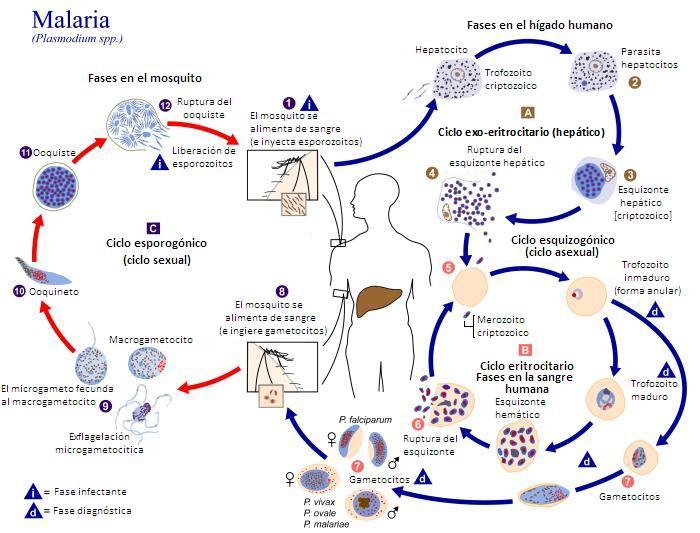
La dificultad está en desarrollar una vacuna contra un organismo, el protozoo plasmodio, cuyas células eucariotas, con núcleo, son iguales que las nuestras. Por tanto, cualquier ataque contra estas células puede dañar también al enfermo. Y, además, el plasmodio tiene un ciclo de vida complicado, con varias fases y varios huéspedes, y en todos ellos cambia lo suficiente como para necesitar una vacuna concreta para cada una de esas fases.
Los expertos, con modestia y después de intensos debates, se han marcado dos objetivos no excluyentes entre sí: conseguir una vacuna con una eficacia del 75% y que se mantenga activa durante dos años; y, también, que tenga una respuesta rápida a la malaria, con una eficacia mayor del 50% y que se mantenga más de un año.
Para 2013 ya existían, por lo menos, 58 vacunas en diferentes fases de desarrollo y, de ellas, 17 estaban en ensayos clínicos. En la revisión de Simon Draper y sus colegas, el número de vacunas en ensayo clínico ha subido hasta 24 en 2018.
Las vacunas se busca que actúen, como decía, contra diferentes fases del ciclo vital. En primer lugar, debe actuar sobre los esporozoitos, la fase que entra en la sangre con la picadura del mosquito. Los esporozoitos entran en las células del hígado o hepatocitos y se reproducen. Después, en la fase merozoito, invaden los glóbulos rojos o hemocitos en la sangre y se siguen dividiendo. Cuando se reproducen tanto que destruyen los glóbulos rojos y se liberan en la sangre provocan los accesos de fiebre típicos de la malaria. Por lo tanto, se buscan vacunas contra los esporozoitos, cuando entran en la sangre por la picadura, y contra los hepatocitos infectados para que no liberen más merozoitos, en la sangre que puedan invadir los glóbulos rojos. Cuando el parásito está en los glóbulos rojos, la vacuna no bloquea la infección pero consigue atenuar su número y bajar la severidad de la enfermedad.
En esta fase el parásito libera gametos, masculinos y femeninos, pues está en la fase sexual del ciclo. Otro objetivo es evitar que libere estos gametos que son los que, en nuevas picaduras, vuelven a los mosquitos y extenderán la enfermedad en la población.
En resumen, se buscan vacunas contra los esporozoitos, los merozoitos en el hígado y los gametocitos. Y, más en detalle, para los esporozoitos está en bloquear la entrada o el crecimiento en las células del hígado. En los merozoitos se intenta bajar la severidad de la enfermedad, disminuir la división en las células del hígado y evitar la salida a la sangre y la entrada en los glóbulos rojos. Y, en los gametocitos, se buscan anticuerpos que alteren el desarrollo en el tubo digestivo del mosquito donde se alojan.

Otro objetivo, muy actual, es conseguir inactivar al parásito en el propio mosquito. Los gametos llegan al tubo digestivo del insecto, se une y dan lugar a los esporozoitos que se almacenan en las glándulas salivares e irán a otro enfermo con la picadura. Así comienza de nuevo el ciclo del plasmodio. Ahora se busca una vacuna que impida la formación de esporozoitos o los atenúe en el mosquito. Conseguirá evitar que la enfermedad se propague por las picaduras de los insectos.

En 1967, Ruth Nussenzweig publicó que habían logrado una inmunización parcial en roedores con la inyección de plasmodios debilitados obtenidos de mosquitos irradiados con rayos X. El método es laborioso pues, para conseguir los esporozoitos tenía que irradiar los mosquitos y después, hacer la disección y extraer las glándulas salivares donde se acumulan los plasmodios. Fue la primera investigación que trató mosquitos para conseguir esporozoitos debilitados.
Entre los intentos anteriores al estudio de Nussenzweig destaca el publicado en 1942, en plena Guerra Mundial y llegado desde la India, cuando la malaria era el principal problema médico de las tropas aliadas en Asia. Paul Russell y Badri Nath Mohan, del Instituto Pasteur del Sur de la India en Coonoor, utilizaron esporozoitos atenuados para una vacuna que impedía la llegada del parásito a los glóbulos rojos. La ensayaron en aves, como malaria aviar, y en gallinas. Consiguieron una disminución de la mortalidad del 21%. Preparaban los esporozoitos atenuados exponiendo a rayos ultravioleta las glándulas salivares de mosquitos infectados. Allí se encuentran los esporozoitos que se transmiten con la picadura. Disolvían las glándulas irradiadas en suero y lo inyectaban a las gallinas. Para los historiadores de la lucha contra la malaria es la primera publicación con un método con el que se sigue trabajando en la actualidad.
El hallazgo de Ruth Nussenzweig sirvió al grupo de David Clyde, de la Universidad de Maryland, para conseguir, en 1975, una cierta inmunización contra la malaria. Expuso a los voluntarios a la picadura de insectos irradiados y consiguió activar su sistema inmune contra el plasmodio, pero solo duró tres meses para falciparum y seis meses para vivax.
Fue también en los setenta cuando Richard Carter y David Chen, de los Institutos Nacionales de la Salud en Bethesda, ensayaron una nueva vacuna para la malaria en aves que, en un doble paso por el mosquito y el pollo, conseguía una efectividad interesante. Inyectaban a los pollos con sangre que llevaba Plasmodium gallinaceum irradiado con rayos X y tratado con formol. Cuando los mosquitos picaban a estos pollos y se alimentaban con su sangre, absorbían los plasmodios irradiados. En esos pollos, el número de parásitos en su tubo digestivo eran un 95%-98% menor que en los pollos control. La caída llegaba al 99% si se utilizaban gametos del plasmodio irradiados.
Años más tarde, entre 1989 y 1999, el grupo de Stephen Hoffman, del Centro de Investigación Médica de la Armada de Estados Unidos, ensayó una vacuna con picaduras de insectos irradiados con rayos gamma procedentes de cobalto o cesio radioactivos. Consiguieron, con once voluntarios, atenuar la enfermedad. Los esporozoitos del plasmodio entraban en las células del hígado pero no se reproducían y no llegaban a los glóbulos rojos. La protección, con nuevas dosis, duraba en algunos voluntarios hasta las 42 semanas.
Años antes, en 1980, el grupo de Nussenzweig había conseguido identificar una de las proteínas que recubre la superficie del plasmodio. Con este hallazgo se inició una línea de investigación todavía muy actual. Estas proteínas de la superficie del plasmodio, aisladas, pueden provocar una respuesta inmune en el enfermo y ser la base para una vacuna eficaz. Como siempre, son la eficacia de la vacuna y su duración condiciones esenciales para conseguir que sea útil. Sin embargo, el ciclo vital del plasmodio implica que estas proteínas de la superficie cambian en cada fase y, por ello, solo se pueden conseguir, por ahora, vacunas contra una fase concreta y no contra el ciclo completo.

Estas proteínas de superficie son la base de una de las vacunas más desarrolladas en este momento, la llamada RTS,S, desarrollada por el grupo de Pedro Alonso, del Centro de Salud Internacional del Hospital Clínic de Barcelona y fundador del Centro de Investigación en Salud de Manhiça, en Mozambique. Está dirigida contra la especie Plasmodium falciparum, la más extendida y letal de las especies del parásito de la malaria. Utiliza, para activar el sistema inmune, dos proteínas de la superficie del plasmodio llamadas RTS y S, y de ahí el nombre de la vacuna. Son de la fase anterior a la entrada de los esporozoitos en las células del hígado y los anticuerpos también pueden destruir los hepatocitos infectados.
Desde 2010, con el nombre comercial de Mosquirix y desarrollada con financiación de la empresa farmacéutica GlaxoSmithKline y de la Fundación Bill y Melinda Gates, la vacuna está en ensayos clínicos muy adelantados. Recibió la aprobación de la Agencia Europea de Medicamentos el 24 de julio de 2015.
La fase clínica II se ensayó en 2022 niños, en Mozambique y en el año 2004, con una reducción del 58% de niños enfermos con malaria severa, con el 77% en menores de dos años y, en general, del 30%. Ahora se está probando en un ensayo poblacional en varios países africanos con 15460 niños de 5 a 17 meses de edad. Los países son Burkina Faso, Ghana, Gabón, Kenia, Tanzania, Malawi y Mozambique. Toman tres dosis de la vacuna, con un mes de intervalo entre dosis, y un refuerzo a los 18 meses. La eficacia es del 55.8% en 2011 y del 31.3% en 2012. La conclusión final es que la eficacia es del 31% en niños de 6 a 12 meses. La duración de la inmunidad está por los 40 meses. Con parecidos métodos y objetivos se está ensayando una vacuna contra la especie Plasmodium vivax.
Otra vacuna en ensayos clínicos es la PfSPZ, de la compañía Sanaria, que utiliza esporozoitos atenuados de falciparum para provocar la inmunidad del vacunado. Se ha ensayado en 2016 con 33 adultos voluntarios, todos hombres de 18 a 35 años, en la isla de Bioko, en Guinea Ecuatorial. Reciben tres dosis de la vacuna o de un placebo con intervalos de ocho semanas. La aparición de anticuerpos contra falciparum se detecta en el 70% de los voluntarios. Ahora se está ensayando en 135 voluntarios con edades de 6 meses a 65 años.
Es una vacuna segura y bien tolerada, pero los investigadores buscan conseguir una respuesta inmune más fuerte contra falciparum, quizá con más dosis.
También es conocida y tema de muchos debates científicos y en los medios la vacuna que desarrolló el investigador colombiano Manuel Elkin Patarroyo en los años noventa. Utilizó una proteína de pequeño tamaño y sintética similar a las que recubren el plasmodio. La vacuna se llama SPf66 y se ensayó en los noventa en Sudamérica y África. Tuvo una eficacia del 26% en Sudamérica y prácticamente nula en los ensayos africanos. El debate sobre esta vacuna es intenso pues los datos de efectividad, según el ensayo de que se trate, llegan hasta el 82% con falciparum y el 60% con vivax o caen al 26% como ya he mencionado.
Un enfoque diferente y original es el de Rhoel Dinglasan y sus colegas, de la Universidad Johns Hopkins, que pretende inmunizar al mosquito para evitar que el plasmodio complete su ciclo vital. El parásito utiliza una enzima concreta para unirse a la pared del tubo digestivo del insecto y continuar su desarrolla. Dinglasan aisló el enzima y provocó inmunidad ante él de manera que el plasmodio, al no poder utilizar el enzima, no completó su ciclo. Consiguió una eficacia del 100% para falciparum y del 98% para vivax. Sin embargo, el método está en sus primeros pasos de investigación y pruebas. El mismo grupo ha encontrado un metabolito aislado de líquenes que también bloquea la maduración del plasmodio en el mosquito.
Referencias:
Alonso, P.L. et al. 2004. Efficacy of the RTS,S/ASO2 vaccine against Plasmodium falciparum infection and disease in Young African children: randomised controlled trial. Lancet 364: 1411-1420.
Amador, R. et al. 1992. Safety and immunogenicity of the synthetic malaria vaccine SPf66 in a large field trial. Journal of Infectious Diseases 166: 139-144.
Amador, R. et al. 1992. The first field trials of the chemically synthesized malaria vaccine SPf66: safety, immunogenicity and protectivity. Vaccine 10: 179-184.
Ballou, W.R. & C.P. Cahill. 2007. Two decades of commitment to malaria vaccine development: GlaxoSmithKline Biologicals. American Journal of Tropical Medicine and Hygiene 77 Suppl 6: 289-295.
Carter, R. & D.H. Chen. 1976. Malaria transmission blocked by immunisation with gametes of the malaria parasite. Nature 263: 57-62.
Clyde, D.F. et al. 1975. Immunization of man against falciparum and vivax malaria by use of attenuated sporozoites. American Journal of Tropical Medicine and Hygiene 24: 397-401.
Draper, S.J. et al. 2018. Malaria vaccines: Recent advances and new horizons. Cell Host & Microbe 24, July 11.
Hoffman, S.L. et al. 2002. Protection of humans against malaria by immunization with radiation-attenuated Plasmodium falciparum sporozoites. Journal of Infectious Diseases 185: 1155-1164.
Nussenzweig, R.S. et al. 1967. Protective immunity produced by the injection of X-irradiated sporozoites of Plasmodium berghei. Nature 216: 160-162.
Olotu, A. et al. 2018. Advancing global health through development and clinical trials partnerships: A randomized placebo-controlled, doublé-blind assessment of safety, tolerability, and immunogenicity of PfSPZ vaccine for malaria in healthy Equatoguinean men. American Journal of Tropical Medicine and Hygiene 98: 308-318.
Pastrana-Mena, R. et al. 2016. A malaria transmission-blocking (+)-usnic acid derivative prevents Plasmodium zygote-to-ookinete maturation in the mosquito midgut. ACS Chemical Biology 11: 3461-3472.
Russell, P.F. & B.N. Mohan. 1942. 1942. The immunization of fowls against mosquito-borne Plasmodium gallinaceum by injection of serum and of inactivated homologous sperozoites. Journal of Experimental Medicine 76: 477-495.
Vaughan, A.M. & S.H.I. Kappe. 2017. Genetically attenuated malaria parasites as vaccines. Expert Review of Vaccines 16: 765-767.
Wikipedia. 2018. Malaria vaccine. 14 July.
Yoshida, N. et al. 1980. Hybridoma produces protective antibodies directed against the sporozoite stage of malaria parasite. Science 207: 71-73.
Sobre el autor: Eduardo Angulo es doctor en biología, profesor de biología celular de la UPV/EHU retirado y divulgador científico. Ha publicado varios libros y es autor de La biología estupenda.