Los pigmentos respiratorios

Llamamos pigmentos respiratorios a un grupo de proteínas que tienen la propiedad de combinarse de forma reversible con oxígeno molecular. Por esa razón, pueden transportar oxígeno, captándolo en un lugar y liberándolo en otro. Todos los pigmentos respiratorios son metaloproteínas, o sea, proteínas que contienen átomos metálicos. Y los llamamos pigmentos porque, al menos en algunos momentos, tienen un color intenso.
El O2 tiene una solubilidad relativamente baja en agua, por lo que es muy limitada la capacidad de las disoluciones acuosas, como son la hemolinfa o el plasma sanguíneo, para transportar oxígeno. Gracias a los pigmentos respiratorios de los que los animales se han dotado, la capacidad de la sangre o equivalente para transportarlo es muy superior a la que tendrían sin ellos, y pueden satisfacer las necesidades que se derivan de altos niveles de actividad metabólica. Para hacernos una idea de lo que representa su contribución, 100 ml de sangre humana contienen, al salir del pulmón, 0,4 ml de O2 en forma disuelta y 19,6 ml combinados con la hemoglobina. O sea, la denominada capacidad de oxígeno de la sangre se multiplica por cincuenta gracias a su pigmento. Es cierto que los mamíferos somos los animales en los que la contribución del pigmento es máxima y que en otros puede ser muy inferior, pero en cualquier caso, se trata de una contribución importante.
Cuando un pigmento respiratorio se encuentra combinado con el oxígeno decimos que está oxigenado y, en caso contrario, que está desoxigenado. No utilizamos los términos oxidado y reducido para denominar esos dos estados alternativos. La combinación del oxígeno con un pigmento no es químicamente equivalente a una oxidación. En una oxidación los electrones de los átomos metálicos del pigmento son parcialmente transferidos a la molécula de oxígeno, pero no es una transferencia completa como la que ocurre en una oxidación. De hecho, si la molécula de pigmento se oxidase realmente perdería su capacidad para transportar oxígeno. Utilizamos los prefijos oxi- y desoxi- para denominar a las dos formas del pigmento: oxihemoglobina y desoxihemoglobina, por ejemplo. Hay cuatro tipos o categorías de pigmentos respiratorios: hemoglobinas, hemocianinas, hemeritrinas y clorocruorinas. Cada una de esas categorías agrupa a compuestos relacionados, no a estructuras químicas únicas.
Existen notables similitudes entre la forma en que los pigmentos respiratorios se unen al oxígeno y la forma en que las enzimas se unen a sus sustratos. En ambos casos la unión ocurre en sitios específicos, y se produce mediante enlace débil no covalente. Al unirse el O2 con el pigmento, este modifica ligeramente su conformación, como ocurre con las enzimas. Igualmente, en ambos casos cabe hablar de afinidad, que en este caso refleja la facilidad con la que el oxígeno se une al pigmento. Los pigmentos se puede unir con otras sustancias, también en sitios específicos, y esa unión modifica sus propiedades y la facilidad con que se combina con el oxígeno; a esas sustancias se las denomina moduladores alostéricos. Las moléculas de pigmento suelen estar formadas por dos o más subunidades. Las subunidades son proteínas unidas entre sí mediante enlaces no covalentes. Cada subunidad tiene un sitio de unión para el oxígeno y muestran cooperatividad entre los sitios de unión de las diferentes subunidades. Quiere ello decir que la unión de una molécula de oxígeno al sitio de unión de una subunidad, modifica la facilidad con la que otros sitios se combinan con otras moléculas de O2. Esas variaciones se producen como consecuencia de los cambios conformacionales antes citados.
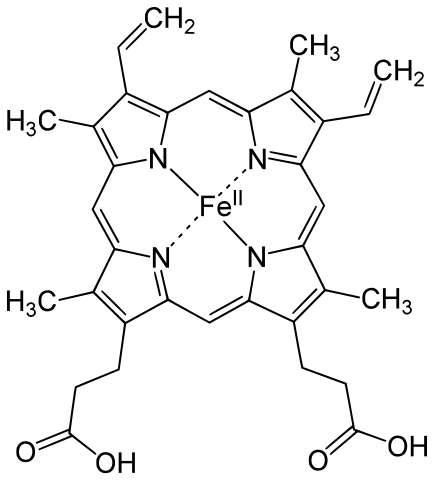
Las hemoglobinas y las clorocruorinas consisten en largas cadenas de aminoácidos (globinas) unidas de forma no covalente a sendos grupos prostéticos (grupos hemo) que son metaloporfirinas. El grupo prostético es común a todos los pigmentos de una misma categoría, ya sean hemoglobinas o clorocruorinas, y es ahí donde se produce la unión con el oxígeno. Los pigmentos de una misma categoría difieren en las cadenas polipeptídicas. De hecho, la diversidad de propiedades y funciones de unas y otras hemoglobinas, por ejemplo, tiene su origen en las diferentes estructuras de sus cadenas. Los grupos hemo de las hemoglobinas y de las clorocruorinas son metaloporfirinas en las que el metal es el hierro. Las clorocruorinas tienen la particularidad de ser verdes en disoluciones diluidas y rojas en concentradas. Las hemoglobinas son rojas. Las hemocianinas son la segunda categoría pigmentaria más común. A diferencia de hemoglobinas y clorocruorinas, no tienen grupo hemo. Y además, en vez de hierro contienen cobre, que se encuentra unido directamente a la proteína. El sitio de unión con la molécula de O2 contiene dos átomos de metal. Cuando se encuentran desoxigenadas carecen de color, y cuando están combinadas con el O2 son azules. Por último tenemos las hemeritrinas, que, como las hemocianinas, carecen de grupo hemo. El metal de estas es el hierro, también ligado directamente a la proteína.
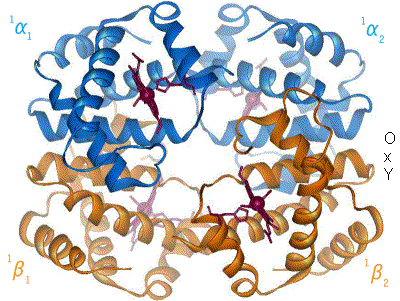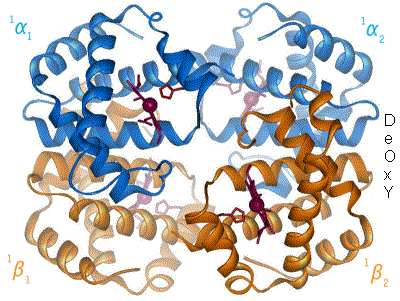
El pigmento respiratorio mejor conocido es la hemoglobina humana. La de un individuo adulto consta de cuatro subunidades (se dice que es tetramérica) cuyas globinas están formadas por algo más de 140 aminoácidos. Se conocen más de un centenar de formas mutantes, la mayoría de las cuales solo difiere de la forma normal en un único aminoácido. El peso molecular de las subunidades se encuentra entre 16000 y 17000 daltons. La sangre adulta contiene dos tipos de globinas, denominadas α (141 aminoácidos) y β (146 aminoácidos), de manera que en una molécula de hemoglobina hay dos de cada tipo. Hemos especificado que los datos anteriores corresponden a la hemoglobina de personas adultas, porque a lo largo del desarrollo, desde la fase embrionaria hasta semanas después del nacimiento, cambian de manera notable su composición y características. En otras especies no es raro que coexistan más de una variedad de hemoglobina en la sangre, cada una con diferentes características en lo relativo a su unión con el O2; esa variedad permite a los animales que la poseen transportar oxígeno en un amplio rango de condiciones ambientales.
Fuentes:
Richard W. Hill, Gordon A. Wyse & Margaret Anderson (2004): Animal Physiology. Sinauer Associates, Sunderland
John D. Jones (1972): Comparative physiology of respiration. Edward Arnold, Edinburgh
Sobre el autor: Juan Ignacio Pérez (@Uhandrea) es catedrático de Fisiología y coordinador de la Cátedra de Cultura Científica de la UPV/EHU

ana violeth sanabria nuñes
muy buena explicacion