El dióxido de carbono es un producto terminal del metabolismo energético aerobio. Su presencia en los fluidos internos a altas concentraciones altera el pH, por lo que ha de ser eliminado. El CO2 sigue la misma ruta que el O2, aunque en sentido contrario. Pasa de las células a la sangre u otros fluidos internos y de ahí al exterior a través de la pared corporal o del órgano respiratorio.
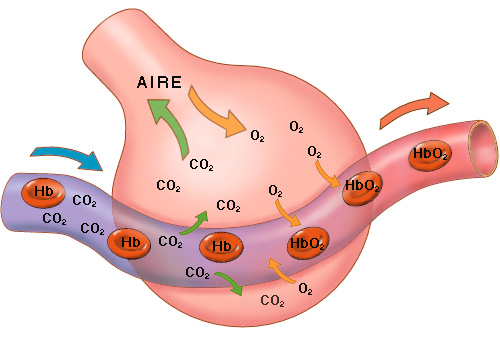
Sin embargo, el transporte de dióxido de carbono se produce de forma muy diferente a como ocurre el del oxígeno. El CO2 puede hallarse en la sangre (1) en forma disuelta, (2) combinado con proteínas sanguíneas en forma de compuestos carbamino, y (3) combinado químicamente con el agua en forma de ión carbonato o bicarbonato.
Cuando el CO2 se disuelve en disoluciones acuosas experimenta una serie de reacciones:
CO2 + H2O ⇌ H2CO3
H2CO3⇌ H+ + HCO3–
HCO3–⇌ CO32- + H+
En condiciones fisiológicas, el ión carbonato se encuentra en los fluidos de la mayoría de animales en concentraciones muy bajas, por lo que a los efectos que nos interesan aquí podemos limitarnos a la siguiente reacción:
CO2 + H2O ⇌ H+ + HCO3–
La concentración de dióxido de carbono disuelto en una disolución acuosa dependerá, como ocurre con el oxígeno, de su tensión parcial y vendrá determinada por los principios de la solubilidad de los gases. Sin embargo, la concentración de bicarbonato va a depender de la presencia de sustancias tamponadoras (amortiguadoras) del pH.
Aplicando la ley de acción de masas a la ecuación anterior tenemos que [HCO3–] [H+]/[CO2] = K, siendo K una constante.
Dado que [CO2] se mantiene constante, también lo es el producto [CO2] K, por lo que la expresión anterior indica que la concentración del ión bicarbonato ([HCO3–]) dependerá de la concentración de protones ([H+]), de manera que cuanto menor sea esta, mayor será aquella. Por lo tanto, si la concentración de protones se mantiene baja, el bicarbonato podrá alcanzar una concentración relativamente alta. Por esa razón, si en la disolución hay sustancias tamponadoras efectivas, la concentración de protones podrá mantenerse relativamente baja y, en consecuencia, podrá alcanzarse una alta concentración de bicarbonato.
Las reacciones de amortiguación pueden representarse de la siguiente forma: HX ⇌ H+ + X– , donde X– representa a los compuestos o grupos químicos que se combinan con los protones, amortiguando el pH de ese modo. Así, cuando se añaden protones a una solución tamponada, la reacción se desplaza a la izquierda, lo que ayuda a mantener a bajas concentraciones la concentración de H+. Y por otro lado, si se retiran protones de la disolución, la reacción se desplazará hacia la derecha, liberándose aquellos del compuesto HX. Como en el caso anterior, de acuerdo con la ley de acción de masas tenemos que [H+] [X–]/[HX] = K’, siendo K’ otra constante.
Se da la circunstancia de que la efectividad de una reacción amortiguadora es máxima cuando la mitad de los grupos X– están combinados con los H+ y la otra mitad no lo están; en otras palabras, el cambio que sufre el pH al añadir o retirar protones de la disolución es mínimo cuando [HX] = [X–]. Bajo esas condiciones [H+] = K’, por lo que la máxima capacidad tamponadora se produce cuando pH = pK’1. Así pues, si se aplica este principio a una sangre cualquiera, las reacciones de amortiguación relevantes son aquellas cuyos valores de pK’ se encuentran próximos al pH de la sangre.
La sangre de los mamíferos y de la mayor parte de los demás vertebrados es muy eficaz amortiguando el pH porque contiene abundantes grupos tampón, la mayor parte en la hemoglobina. Los grupos con valores adecuados de pK’ son los amino terminales de las proteínas sanguíneas y, sobre todo, los grupos imidazol, que se encuentran allí donde en una estructura proteica haya histidina. Son estos últimos los principales grupos amortiguadores, y son tan efectivos que retiran de la disolución el 99.999% de los protones que se producen. Gracias a ello, la sangre tiene capacidad para captar importantes cantidades de dióxido de carbono, ya que la mayor parte del mismo se encuentra en forma de ión bicarbonato.
También en el caso del CO2, como en el del O2, cabe hablar de curvas de disociación o curvas de equilibrio, aunque la forma y el significado de estas difiere de forma notable de las correspondientes para el oxígeno. Como se ha señalado más arriba, además de la fracción que se combina con el agua para dar iones bicarbonato y protones, la sangre contiene CO2 en forma disuelta y también en forma de compuestos carbamino. A las tensiones parciales de CO2 propias de la sangre arterial y de la sangre venosa, su concentración total (disuelto o en forma de otra especie química) no se aproxima a un valor asintótico máximo como lo hace el O2, sino que mantiene una tendencia creciente.
En las especies cuya sangre experimenta el efecto Bohr, la curva de disociación del CO2 es dependiente del grado de oxigenación de la sangre. A este fenómeno se le denomina efecto Haldane y consiste en una menor afinidad para con el CO2 de la sangre oxigenada que de la desoxigenada. Esto quiere decir que cuando la sangre llega al órgano respiratorio y empieza a captar oxígeno, cede el CO2 con mayor facilidad. Se debe a que la sangre oxigenada tiene menos capacidad amortiguadora que la desoxigenada, razón por la cual, también tiene menos capacidad para contener iones bicarbonato. Como ocurría con la descarga de O2 en los tejidos a causa del efecto Bohr, el efecto Haldane facilita la descarga de CO2 en la sangre que llega a los pulmones, con lo que eleva la capacidad de la sangre para transportarlo.
La conversión de CO2 en bicarbonato en el plasma sanguíneo de los vertebrados es un proceso relativamente lento: se necesita un minuto para alcanzar el equilibrio. Sin embargo, las cosas son muy diferentes en el interior de los eritrocitos, ya que en estos se encuentra la anhidrasa carbónica, enzima que acelera el proceso de forma muy notable.
Así pues, cuando entra el CO2 en la sangre, una pequeña parte se disuelve y otra, mucho más importante, difunde rápidamente al interior de los glóbulos rojos. Allí una fracción se combina con los grupos amino de la hemoglobina para formar carbaminohemoglobina (o carbohemoglobina) y otra fracción se convierte rápidamente en bicarbonato gracias a la acción de la anhidrasa carbónica. Ambos procesos dan lugar a la aparición de protones, que se unen, principalmente, a los grupos imidazol de la misma hemoglobina y de esa forma se amortigua el pH del interior de los glóbulos rojos. El bicarbonato formado en los eritrocitos, por su parte, no se acumula en su interior, ya que es intercambiado por iones cloruro gracias a la acción de una transportador antiporte de membrana. De no producirse tal intercambio, el aumento de su concentración dentro de los glóbulos rojos provocaría una disminución de la velocidad de la reacción catalizada por la anhidrasa carbónica.
Aparte de en los eritrocitos, también hay anhidrasa carbónica en las membranas de las células endoteliales que forman las paredes de los capilares pulmonares y en las membranas de las células musculares esqueléticas en algunos vertebrados. Los protones que resultan de la reacción del CO2 con el agua para dar bicarbonato se combinan con proteínas plasmáticas, lo que permite amortiguar el pH también en el plasma.
Un aspecto muy importante del transporte de CO2 en la sangre es que cada una de las formas en que este se produce contribuye en una medida muy diferente al total. Veamos esto con cierto detalle en la sangre humana2, la más estudiada y, por ello, mejor conocida a estos efectos.
La concentración total de CO2 en la sangre venosa es de 23.21 mmol·l-1 y en la arterial, de 21.53 mmol·l-1, por lo que la descarga total es de 1.68 mmol·l-1. La fracción que se descarga, como puede verse, es muy pequeña, de algo más de un 7% del dióxido de carbono que hay en la sangre venosa.
En el plasma venoso hay 16.99 mmol·l-1, de los que 0.8 se encuentran en forma disuelta y 16.19 en forma de ión bicarbonato; en el plasma arterial, por su parte, la concentración total es de 15.94 mmol·l-1, del que 0.71 se encuentra disuelto y 15.23 como ión bicarbonato. La descarga total es de 1.05 mmol·l-1 (0.09 en forma disuelta y 0.96 en forma de iones bicarbonato), por lo que esta es la principal contribución al transporte de dióxido de carbono, ya que representa el 62.5% de la total. Hay que tener en cuenta, no obstante, que la mayoría de iones bicarbonato se forman en el interior de los eritrocitos por lo que, en última instancia, los glóbulos rojos juegan un papel determinante y muy principal en el proceso.
Los eritrocitos contienen 6.22 mmol·l-1 de CO2 en la sangre venosa y 5.59 mmol·l-1 en la arterial. La descarga de esa fracción es de 0.63 mmol·l-1, un 37.5% del total. Y en lo relativo a las diferentes formas de transporte, se puede precisar que en forma disuelta se transporta una fracción mínima (las concentraciones venosa y arterial son, respectivamente, de 0.39 y 0.34 mmol· l-1), en forma de bicarbonato la descarga es de 0.13 mmol· l-1 (4.41 y 4.28 mmol·l-1 en sangre venosa y arterial, respectivamente), y 0,45 mmol· l-1 en forma de carbohemoglobina, aunque las concentraciones de CO2 en esta forma son realmente bajas (1.42 y 0.97 mmol· l-1). Como puede apreciarse, aunque la concentración de dióxido de carbono en forma de carbaminos es relativamente baja, su contribución al transporte no lo es tanto.
En conclusión cabe señalar que la mayor parte del CO2 se transporta en forma de CO3H–, ya que considerada en conjunto la descarga de esa forma es de 1.09 mmol·l-1, un 65% de la total. En forma de compuestos carbamino se descargan los 0.45 mmol· l-1, un 27% del total. El resto, 0.14 mmol·l-1, se descarga de forma disuelta, pero tan solo representa un 7%. En todo caso, conviene resaltar que el pigmento respiratorio es protagonista principal, tanto de forma directa –por su contribución gracias a la combinación del CO2 con grupos amino y grupos imidazol- como de forma indirecta, por su efecto amortiguador del pH- del transporte del dióxido de carbono.
Fuentes:
Richard W. Hill, Gordon A. Wyse & Margaret Anderson (2004): Animal Physiology. Sinauer Associates, Sunderland.
John D. Jones (1972): Comparative physiology of respiration. Edward Arnold, Edinburgh.
Lauralee Sherwood, Hillar Klandorf & Paul H. Yancey (2005): Animal Physiology: from genes to organisms. Brooks/Cole, Belmont.
Notas:
1pK’ = -log K’
2Las cifras no son muy diferentes para el resto de mamíferos, aves y reptiles. Sin embargo, en peces y anfibios no se forman grupos carbamino porque su hemoglobina se encuentra acetilada y eso impide la combinación con el CO2.
Sobre el autor: Juan Ignacio Pérez (@Uhandrea) es catedrático de Fisiología y coordinador de la Cátedra de Cultura Científica de la UPV/EHU

El transporte de dióxido de carbono | Gen Altruísta
[…] condiciones [H+] = K’, por lo que la máxima capacidad tamponadora se produce cuando pH = pK’1. Así pues, si se aplica este principio a una sangre cualquiera, las reacciones de amortiguación […]
El transporte de dióxido de carbono – Gen Altruista – Ana Herbsztein
[…] condiciones [H+] = K’, por lo que la máxima capacidad tamponadora se produce cuando pH = pK’1. Así pues, si se aplica este principio a una sangre cualquiera, las reacciones de amortiguación […]