La Facultad de Ciencias de Bilbao comenzó su andadura en el curso 1968/69. 50 años después la Facultad de Ciencia y Tecnología de la UPV/EHU celebrará dicho acontecimiento dando a conocer el impacto que la Facultad ha tenido en nuestra sociedad. Durante las próximas semanas en el Cuaderno de Cultura Científica y en Zientzia Kaiera se publicarán regularmente artículos que narren algunas de las contribuciones más significativas realizadas a lo largo de estas cinco décadas. Comenzamos con la serie “Espectrometría de masas”, técnica analítica que supone el ejemplo perfecto del incesante avance de la Ciencia y la Tecnología.
A principios del siglo XX J. J. Thomson estudiaba el cambio de trayectoria de los iones de ciertos gases sometidos a campos eléctricos y magnéticos. Estos experimentos derivaban del estudio de rayos catódicos que le habían valido el premio Nobel en 1906 y que habían esclarecido la naturaleza del electrón, entonces una partícula subatómica desconocida. Sir Thomson observó que los gases con carga positiva se podían separar en función de su relación masa/carga y que, conociendo el valor del campo eléctrico y magnético aplicado, podría determinar esta relación. En otras palabras, podía saber cuánto pesaban átomos o moléculas. Había nacido la espectrometría de masas.
La espectrometría de masas es hoy en día la técnica analítica más versátil y potente que disponemos. En campos como el análisis forense, el análisis de alimentos o el estudio de contaminantes nos permite determinar la concentración de compuestos a niveles extremadamente bajos. Además, también sirve para identificar nuevas moléculas, algo que resulta de gran ayuda en el desarrollo de fármacos. Por si esto fuera poco, en el ámbito de la Medicina y la Fisiología está propiciando grandes avances médicos, porque permite estudiar cómo se distribuyen ciertas moléculas en órganos vitales. A lo largo de los artículos que componen esta serie nos adentraremos en este fascinante abanico de aplicaciones. Pero antes, veamos cómo hemos podido llegar a este punto en apenas cien años.
Los primeros pasos
Viajemos hasta la Universidad de Cambridge, donde hemos dejado a Thomson trabajando con su protegido Francis William Aston. A él le debemos el siguiente gran hito en el campo que nos ocupa. En la Imagen 2 podéis observar el tipo de resultados que obtenían con aquellos primitivos espectrómetros de masas, entonces llamados espectrógrafos de parábola. En la placa fotográfica se pueden ver diferentes marcas ordenadas según las diferentes relaciones masa/carga. Aclararemos este concepto diciendo que no es otra cosa que la masa del átomo (o molécula) dividido entre el número de cargas. Por ejemplo, para el ion CO+ es 28 (la suma de la masa atómica* del carbono-12 y la del oxígeno-16 dividida entre uno), para el Hg+ es 200 y para el Hg2+ es 100 (dado que la masa atómica se divide entre dos por la doble carga). Como curiosidad añadiremos que a este parámetro se le asignó la unidad Th (Thomson) en honor al gran científico inglés, pero no ha sido reconocida internacionalmente y los resultados se presentan con el menos poético m/z.

Aston observó que junto a la señal que correspondía al ion de neón (20 m/z) aparecía otra pequeña señal (22 m/z) cuyo origen era desconocido. ¿Qué demonios hacía eso ahí? Como bueno científicos, realizaron varios experimentos y fueron descartando hipótesis: no se trataba de moléculas de CO2 con doble carga (44/2) ni de hidruro de neón (NeH2). La misteriosa señal aparecía siempre que se analizaba este gas noble y era nueve veces más pequeña. No había otra explicación: también era neón. En 1913 propusieron que el neón era una mezcla de dos tipos de átomos con diferente masa (20 y 22) en proporción 9 a 1. De ahí la diferencia de intensidad en las señales obtenidas. Y de ahí que el peso atómico logrado para este elemento mediante la medida de la densidad fuese 20,2 (el promedio de las masas teniendo en cuenta su abundancia). Aston había descubierto un nuevo isótopo, término que había acuñado hacía poco Frederick Soddy por sugerencia de Margarett Todd para describir los átomos con propiedades idénticas, pero de diferente masa. Hoy en día nos puede parecer un asunto trivial y cualquiera que tenga unas nociones mínimas de química sabrá que esto se debe al diferente número de neutrones. ¡Pero tened en cuenta que todavía no se había descubierto esa partícula subatómica!
Tras la Gran Guerra, Aston mejoró su instrumento y desarrolló los primeros “espectrógrafos de masas” (Imagen 3) que le permitieron descubrir 212 isótopos naturales. Como premio ganó el Nobel de Química en 1922 (Soddy lo había ganado el año anterior). En esta tierna infancia de la espectrometría de masas no nos podemos olvidar de Arthur Dempster que en la Universidad de Chicago diseñó los primeros espectrómetros de sector magnético en los que se basan muchos de los instrumentos actuales y con los que descubrió el uranio-235.

Guerras, avances y difusión
Es, precisamente, el uranio-235 el protagonista de una de las primeras aplicaciones prácticas de la espectrometría de masas. Desgraciadamente. Durante el Proyecto Manhattan, el físico Alfred Nier revolucionó la espectrometría de masas con nuevos instrumentos de sector que permitieron aislar y conocer mejor el isótopo empleado en Little Boy. Pero sería injusto juzgar a Nier por la aplicación que se hizo de sus avances. Este científico fue un visionario que comprendió la importancia de la espectrometría de masas y extendió, en muchas ocasiones de forma altruista, sus usos a campos como la Biología (enriquecimiento de carbono-13) o la Geología (datación isotópica de la corteza terrestre).
Durante los años 40 y los años 50 se realizaron importantes mejoras y aparecieron instrumentos basados en nuevos principios para separar iones. Por su relevancia destacaremos los instrumentos de tiempo de vuelo (Time of Flight) propuestos por W.E. Stephens, en los que la separación se logra por la diferente velocidad a la que se mueven las moléculas al someterlas a un impulso (Imagen 4). Este es el sistema de separación más fácil de visualizar: cuanto más pesada sea la molécula más tiempo tardará en llegar al detector. El otro gran avance fue la creación de los instrumentos tipo cuadrupolo en los que los iones se pueden separar gracias al uso de cilindros que permiten realizar variaciones de corriente continua y radiofrecuencias. Prueba de su importancia es que Wolfgang Paul y Hans Georg Dehmelt obtuvieron el premio Nobel de Física en 1989 por el desarrollo de la trampa iónica, en la que extendieron estos principios en tres dimensiones.
Pero no avancemos tan rápido. Los primeros espectrómetros comerciales no recibieron una calurosa acogida. En gran medida por el desconocimiento de la técnica, la mayoría de las aplicaciones eran meramente cuantitativas, como por ejemplo el análisis de hidrocarburos en refinerías de petróleo. Es decir, se usaban para determinar la concentración de algún compuesto conocido en diferentes muestras (tengamos en cuenta que la señal del compuesto es proporcional a su concentración). De ese modo no se explotaba una de las grandes ventajas que ofrece la espectrometría de masas: la identificación de moléculas desconocidas. Conocer la masa molecular de un compuesto es un gran paso para esclarecer su identidad. Y se puede ir más allá. La molécula se puede fragmentar en el instrumento, por lo que también podemos conocer la masa de los fragmentos y elucidar la estructura original como si de un puzle se tratase. Hubo tres científicos que supieron ver esta gran ventaja: Fred McLafferty (conocido por su reordenamiento), Klaus Biemann y Carl Djerassi (aunque lo más fascinante es que Thomson ya había predicho su aplicabilidad para 1913). Gracias a ellos se extendió el uso de la espectrometría de masas en el campo de la química orgánica, aplicándose inicialmente al descubrimiento de alcaloides y esteroides (Djerassi fue uno de los padres de la píldora anticonceptiva). Así posibilitaron, en gran medida, que la espectrometría de masas se convirtiese, junto a la resonancia magnética nuclear, en la herramienta indispensable para conocer la estructura de nuevas moléculas.
El despegue definitivo
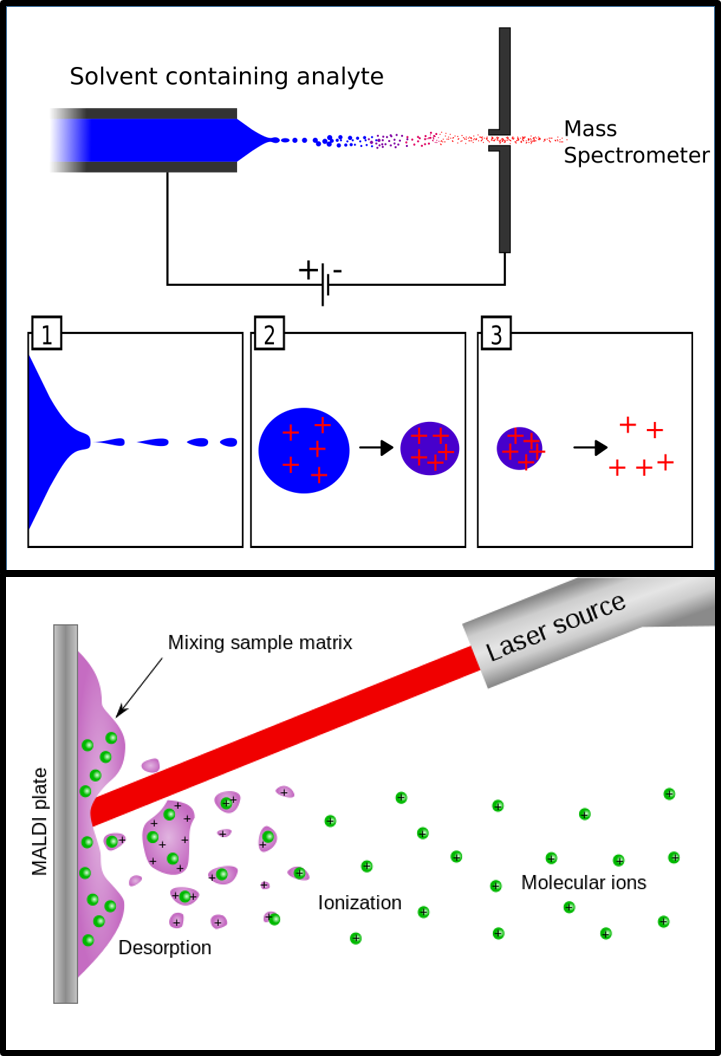
La espectrometría de masas empezaba a despuntar, pero todavía existía un enorme problema: ¿Cómo se convierten las moléculas en iones gaseosos? Hasta ahora nos hemos centrado en cómo medir la masa, dejando de lado este importante aspecto. Recordemos que esta técnica mide la relación masa/carga, así que si las moléculas no están ionizadas de poco nos puede servir. Los métodos empleados hasta finales de los 60 no eran aptos para moléculas no volátiles o provocaban la fragmentación total de la molécula causando la pérdida de información sobre la masa molecular. En esas condiciones la mayoría de biomoléculas no podían ser analizadas, especialmente las proteínas de gran tamaño. Hacía falta ir un paso más allá. Y entonces surgieron la Ionización por Electrospray (ESI) y la Ionización/Desorción Laser Asistida por Matriz (MALDI). Así se les puso alas a las “moléculas elefante” como dijo John B. Fenn en su conferencia por el premio Nobel de Química de 2002.

Por su parte, Tanaka logró ionizar proteínas con un método radicalmente diferente: empleando un láser. Pese a que su mérito como pionero en el uso de la ionización laser es incuestionable, hubo cierta polémica cuando le otorgaron el Premio Nobel. Hay quien piensa que el galardón debería haber recaído en Hillenkamp y Karas, ya que la técnica que actualmente conocemos como MALDI (del inglés Matrix Assisted Laser Desportion/Ionization) fue desarrollada por ellos y difiere en ciertos aspectos de la propuesta por Tanaka. Dejando estos conflictos de lado, sólo queda decir que la técnica MALDI se basa en un sistema de ionización indirecta. A la muestra se le añade una matriz que se ioniza fácilmente con un láser y es esta matriz la que transfiere su carga a las moléculas. Este método de ionización es de un gran interés, especialmente porque permite hacer imágenes de superficies como puede ser un tejido animal.
Durante el siglo XXI han continuado los avances en espectrometría de masas y los equipos de alta resolución (capaces de discernir entra moléculas con una relación masa/carga muy parecida) van ganado espacio. En este aspecto, puede que el mayor avance de los últimos años haya sido la aparición del Orbitrap, un espectrómetro de masas tipo trampa iónica con transformada de Fourier.
Pero del presente de la espectrometría de masas nos ocuparemos durante las próximas entregas de esta serie en la que iremos descubriendo diferentes casos en los que esta técnica ha sido de gran utilidad.
*N. del A. La forma de definir la masa atómica y el peso atómico ha variado a lo largo de los años. Diremos que la masa atómica es la masa de un isótopo específico y el peso atómico es el promedio de todos los isótopos de un elemento teniendo en cuenta su abundancia.
Para saber más:
Simon Maher et al. (2015) “Colloquium: 100 years of mass spectrometry: Perspectives and future trends” Reviews of Modern Physics, 87, 113-135.
Jennifer Griffiths et al. (2008) “A Brief History of Mass Spectrometry” Analytical Chemistry, 80, 5678-5683.
Stu Borman et al. (2003) “A Mass Spec Timeline” Today’s Chemist at Work, September, 47-49.
Sobre el autor: Oskar González es profesor en la Facultad de Ciencia y Tecnología y en la Facultad de Bellas Artes de la UPV/EHU.

Tomás Valdés
Muchas gracias por tu explicación. Imparto docencia a técnicos de laboratorio biomédico y me han resultado muy interesantes tus aclaraciones.
Oskar González
¡Gracias! Me alegra que te haya sido de utilidad.
A new hero is born: La espectrometría de masas al servicio de la justicia — Cuaderno de Cultura Científica
[…] en este punto podemos preguntarnos, ¿En qué puede ayudar la espectrometría de masas en la datación de documentos? ¿Por qué se ha convertido en uno de los detectores más utilizados […]
En busca del compuesto perdido — Cuaderno de Cultura Científica
[…] de policías e investigadores han puesto en nuestras vidas el laboratorio científico y con él, la espectrometría de masas. La realidad es algo diferente a la ficción, pero en ambos casos es cierto que la espectrometría […]
Metabolómica: el todo sobre la suma de las partes — Cuaderno de Cultura Científica
[…] el uso de la resonancia magnética nuclear (RMN). Sin embargo, la metabolómica basada en la espectrometría de masas (MS) ha ido ganando en popularidad con el tiempo. El desarrollo de instrumentos de alta resolución […]
Konposatu galduaren bila – Zientzia Kaiera
[…] telesailek laborategi zientifikoa ekarri dute gure bizitzara eta, harekin batera, baita masa-espektrometria ere. Errealitatean eta fikzioan gertatzen dena ez da guztiz berdina, baina bi kasuetan ere oso […]
Cartografiando territorio inexplorado: imagen por espectrometría de masas — Cuaderno de Cultura Científica
[…] espectrometría de masas es una poderosa técnica analítica que permite determinar la identidad de las moléculas a partir […]
Proteómica: cuando las proteínas y la espectrometría de masas van de la mano — Cuaderno de Cultura Científica
[…] proteínas, es decir péptidos, y pasarlos a fase gaseosa se consideraba una tarea tan posible como hacer volar a un elefante. Sin embargo, el desarrollo y comercialización de dos métodos de ionización a los que se […]
Proteómica: cuando las proteínas y la espectrometría de masas van de la mano – Fluceando
[…] es decir péptidos, y pasarlos a fase gaseosa se consideraba una tarea tan posible como hacer volar a un elefante. Sin embargo, el desarrollo y comercialización de dos métodos de ionización a […]
Espectrometría de masas: de un isótopo de neón a elefantes que vuelan |
[…] artículo Espectrometría de masas: de un isótopo de neón a elefantes que vuelan de Oskar González (Departamento de Química Analítica, ZTF-FCT) se publicó en el blog Cuaderno […]
A new hero is born: La espectrometría de masas al servicio de la justicia |
[…] en este punto podemos preguntarnos, ¿En qué puede ayudar la espectrometría de masas en la datación de documentos? ¿Por qué se ha convertido en uno de los detectores más utilizados […]