La Facultad de Ciencias de Bilbao comenzó su andadura en el curso 1968/69. 50 años después la Facultad de Ciencia y Tecnología de la UPV/EHU celebrará dicho acontecimiento dando a conocer el impacto que la Facultad ha tenido en nuestra sociedad. Durante las próximas semanas en el Cuaderno de Cultura Científica y en Zientzia Kaiera se publicarán regularmente artículos que narren algunas de las contribuciones más significativas realizadas a lo largo de estas cinco décadas. Comenzamos con la serie “Espectrometría de masas”, técnica analítica que supone el ejemplo perfecto del incesante avance de la Ciencia y la Tecnología.
El desarrollo de la actividad humana y el aumento de la contaminación van de la mano, ya que el ser humano ha contaminado el medioambiente desde sus inicios. El punto de inflexión en el nivel de contaminación lo marca la revolución industrial, pero los seres humanos como sociedad no le han dado importancia a este trascendental problema hasta alcanzar su bienestar social y económico. “El ser humano es parte de la naturaleza y la lucha contra ésta es una lucha contra sí mismo”. Así reflexionaba Rachel Carson entorno a este problema en 1962 en su libro “Primavera Silenciosa”, que se puede considerar la primera obra del ecologismo.
De la misma época (1960-1980) son las primeras legislaciones sobre la contaminación medioambiental y también durante el siglo XX se instalaron las primeras depuradoras para tratar las aguas residuales industriales y urbanas. Si bien las primeras normativas y legislaciones se centraron en el control de patógenos y metales, no fue hasta más tarde cuando el control de los compuestos orgánicos adquirió importancia. En un principio, se impuso el control prioritario de los contaminantes orgánicos persistentes o POPs (persistent organic pollutants) debido a su capacidad de acumularse y su toxicidad. En la convención de Estocolmo se recopiló un listado de 12 compuestos, entre los que se encontraban 9 pesticidas clorados, los bifenilos policlorados, las dioxinas y los furanos. Si bien el listado se ha ampliado a 28 compuestos en años sucesivos, existen aún otros en lista de espera. Además de la convención de Estocolmo, la europea Directiva Marco de Aguas o WFD (Water Framework Directive) y la Agencia para la Protección del Medioambiente estadounidense (Environmental Protection Agency, EPA) tienen sus propios listados de contaminantes prioritarios, que incluyen hasta 129 compuestos. Todos ellos conocidos, todos controlados, todos esperables. Pero, ¿son esos los únicos compuestos preocupantes o perjudiciales para el medioambiente? Los contaminantes conocidos y regulados son solo la punta del iceberg. Muchos de los contaminantes que llegan al medioambiente surgen de la actividad diaria del ser humano; sin embargo, es poco lo que conocemos sobre la presencia o efectos nocivos que pueden causar en el medioambiente los más de 70 millones de compuestos que podemos encontrar en bases de datos como Pubchem o Chemspider.
Por tanto, ¿merece la pena husmear en el lado oculto del iceberg? ¿Nos deben preocupar esos compuestos no legislados? Durante los últimos años, la curiosidad de la comunidad científica se ha dirigido a ese lado oculto del iceberg con el objetivo de detectar en el medioambiente compuestos farmacéuticos y de higiene personal, pesticidas no clorados y/o químicos industriales emergentes, entre otros. Así, en lugar de realizar el seguimiento exclusivo de los cientos de compuestos en la punta del iceberg, el reto es ahora monitorizar los miles de compuestos desconocidos que aún están en el lado oculto. ¡Y vaya reto el de las y los “submarinistas” que se dedican a desarrollar métodos analíticos para detectar esos compuestos!

El reto de estos submarinistas lo hacemos nuestro en la química analítica, separando, identificando y cuantificando los compuestos desconocidos de la materia mediante el uso de técnicas instrumentales. De hecho, los retos analíticos y el avance de los métodos de análisis instrumentales van de la mano. Así, hasta hace no mucho, los métodos de análisis desarrollados en los laboratorios de química analítica eran métodos dirigidos; es decir, lejos de ser magos, hemos desarrollado métodos para analizar unos pocos compuestos conocidos. El reto anteriormente mencionado, sin embargo, plantea un nuevo paradigma que supone dar el salto del análisis dirigido al análisis no dirigido para poder abordar el análisis de miles de compuestos emergentes y desconocidos. En el análisis dirigido, debemos elegir previamente qué queremos analizar; en el análisis no dirigido, sin embargo, lo analizamos todo y, posteriormente decidimos qué es lo que nos interesa de toda esa información. De ese modo, el análisis no dirigido, es una herramienta que permite identificar compuestos desconocidos sin tener un conocimiento previo de la composición de la muestra. Como la cantidad de información que se logra en el análisis no dirigido es gigantesca, su tratamiento de datos puede llevar meses. Más aún, en un futuro se puede regresar a esa información y buscar nuevos compuestos interesantes. Entre las herramientas más importantes para la identificación de contaminantes emergentes y desconocidos encontramos la espectrometría de masas de alta resolución o HRMS (high resolution mass spectrometry).

La espectrometría de masas es una técnica analítica que nos ayuda a identificar la huella dactilar de los átomos y las moléculas. Para obtener esa huella dactilar, la espectrometría de masas mide las relaciones masa/carga (m/z) de los átomos/moléculas ionizados en fase gaseosa. De los espectros de masas se puede conocer la masa exacta de átomos y moléculas, determinar la presencia de isótopos y, en los casos en los que ocurra la fragmentación de las moléculas, disponer de la información estructural sobre ellas.
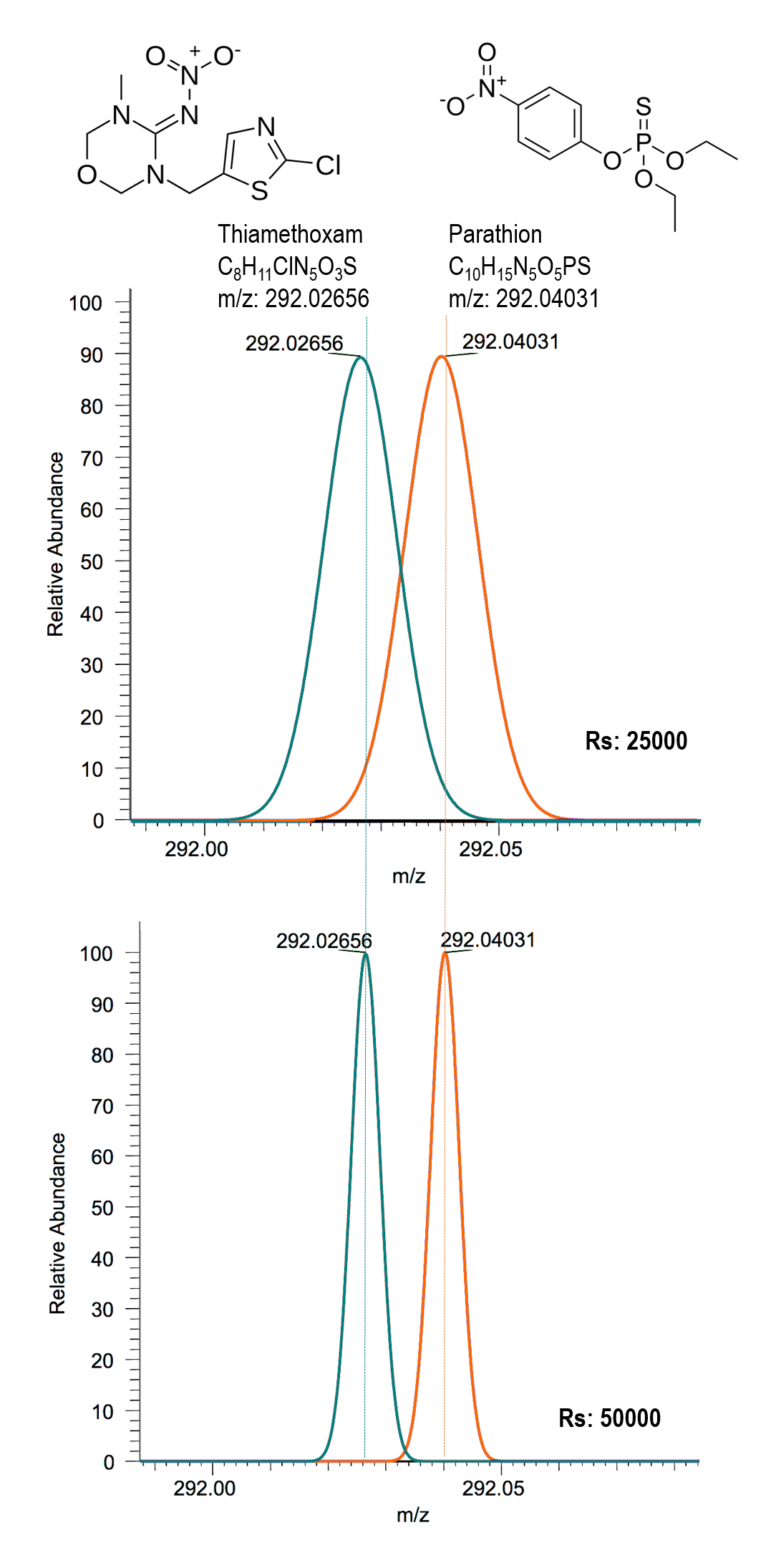
Los espectros de masas se consideran la huella dactilar de los compuestos y se pueden obtener en alta o baja resolución. Pero, ¿para qué necesitamos espectros de masas de alta resolución? Estos últimos, frente a los espectros de masas de baja resolución, miden la relación m/z con mayor exactitud y precisión, permitiendo la diferenciación de moléculas con masas muy próximas. Así, en el ejemplo de la Figura 3, encontramos los insecticidas thiamethoxam y parathion, cuya diferencia de masa es muy pequeña (0,01375 Da), mientras que su fórmula molecular y estructura química es totalmente distinta. Si bien mediante espectrometría de masas de baja resolución somos incapaces de distinguir ambos compuestos (ver Figura 3 arriba), sí lo somos mediante espectrometría de masas de alta resolución (ver Figura 3 abajo).
Nuestro submarinista puede dedicar meses a identificar los compuestos en la zona oculta del iceberg. Es común acoplar la espectrometría de masas a técnicas cromatográficas para separar e identificar los compuestos en el lado oculto del iceberg. Para identificar esos compuestos hay que buscar y entender las huellas dactilares, paso a paso, como si de un puzle se tratara, buscando y uniendo de manera sistemática todas las piezas, hasta completar el puzle. Hasta identificar el compuesto. Veamos un ejemplo.
Supongamos que hemos realizado el análisis no dirigido del agua residual de una depuradora. La cromatografía líquida acoplada a la espectrometría de masas de alta resolución nos ha proporcionado 1000 picos cromatográficos, 1000 posibles compuestos de interés. Disponemos de su masa exacta y perfil isotópico (las masas y relaciones relativas de los isótopos correspondientes a una fórmula química dada). De entre esos 1000 compuestos uno de ellos corresponde a la masa exacta de 345,11443 Da. Con esa masa exacta y gracias al perfil isotópico podemos deducir que algunas de las fórmulas moleculares posibles son: C17H19N3O3S, C11H20N7O2PS, C19H16N5P y C15H24NO4PS. Si comparamos la masa exacta teórica de esas fórmulas moleculares y la masa exacta experimental, el error más pequeño (de -0,000028 Da) corresponde a la fórmula molecular de C17H19N3O3S. Pero, ¿qué es C17H19N3O3S? De acuerdo a las bases de datos que contienen millones de compuestos, existen 14 compuestos con esa fórmula molecular. Entre ellos, es posible que nuestro compuesto desconocido sea el antiácido omeprazol. Sigamos. Ahora nos fijaremos en la fragmentación (los fragmentos significativos de masa exacta obtenidos tras aplicar energía a los compuestos). La fragmentación del compuesto y la del omeprazol coinciden en un 97 %; por tanto, parece que nuestra sospecha es certera, pero, ¿cómo podemos asegurar que el compuesto desconocido corresponde al omeprazol? En una etapa final nuestro submarinista comparará el tiempo de retención (el tiempo que un compuesto de interés requiere para atravesar la columna cromatográfica utilizada para separar los compuestos presentes en una mezcla) obtenido para el compuesto desconocido con el correspondiente al reactivo puro de omeprazol y, ¡voilá!, como coinciden, sin saber que había omeprazol en la muestra, el submarinista ha podido identificarlo entre otros 1000 picos cromatográficos. Y, ¿ahora? Llevar a cabo el mismo proceso con los otros 999 picos cromatográficos aún sin identificar…Ooops, pobre submarinista, ¡aún le resta un largo viaje a nuestro amigo identificando todos los compuestos en el lado oscuro del iceberg!
En el viaje realizado hasta ahora, nuestro submarinista ha centrado su atención en millones de compuestos recopilados en bases de datos debido a su uso y/o toxicidad. Sin embargo, existen otros compuestos de interés que no están recogidos en las bases de datos, como pueden ser los productos de transformación, entre otros. Los productos de transformación pueden surgir de diversas fuentes, tanto de los tratamientos que se dan en las plantas depuradoras como de las reacciones químicas y biológicas que pueden ocurrir al llegar al medioambiente. El examen de los productos de transformación tiene también su importancia, ya que en algunos casos la toxicidad del producto de degradación es superior a la del contaminante de partida. Por ejemplo, según estudios realizados en animales, el filtro UV habitualmente utilizado en cremas solares benzofenona-3 (BP3) se degrada al compuesto desmetilado benzofenona-1 o dihidroxibenzofenona (DHB), cuya actividad estrogénica es mayor que la del producto de partida.
La identificación de los productos de transformación se puede realizar mediante espectrometría de masas. En estos casos, sin embargo, no podremos hacer uso de las bases de datos, ya que en la mayor parte de los casos son desconocidos. En este caso, para poder dirigir la identificación, debemos centrarnos en las transformaciones que puede sufrir un contaminante en concreto. Así, como hemos visto en el ejemplo anterior, de la masa exacta y del perfil isotópico podemos deducir la fórmula molecular. De todas las fórmulas posibles, las candidatas corresponderán a transformaciones (reacciones de fase I o II como oxidación, metilación, glucuronización…) posibles del contaminante estudiado. Una vez identificada la transformación ocurrida, deberemos identificar en qué posición de la molécula ha ocurrido esa transformación. Y, ¿dónde puede encontrar el submarinista esa información? Descifrar la huella dactilar del espectro de masas puede proporcionarle información relevante, concretamente el espectro de masas correspondiente a la fragmentación. Intentemos entenderlo con un ejemplo una vez más.
El filtro UV BP3 que hemos mencionado anteriormente tiene una masa exacta de 229,0859 Da, una fórmula molecular C14H12O3 y en su estructura dos anillos aromáticos (A y B), además de un grupo hidroxilo (-OH) y un grupo metoxi (CH3O-) en el anillo A (ver Figura 4). El espectro de masas correspondiente a la fragmentación de BP3 se puede observar en la Figura 4. Pero, ¿qué le puede ocurrir al BP3 en agua de mar y en presencia de peces, como por ejemplo doradas? La respuesta no es simple ya que, además de acumularse en los distintos tejidos y fluidos biológicos de la dorada, se puede transformar debido a distintas reacciones. Por ejemplo, la masa exacta de uno de los subproductos observados corresponde a 215,0703 Da y, según el perfil isotópico, corresponde a una fórmula molecular de C13H10O3. Si tenemos en cuenta la fórmula molecular de BP3 (C14H12O3 ) original y la del subproducto (C13H10O3) podemos deducir la pérdida de un metilo (–CH3). El lugar más probable para perder ese grupo metilo es el grupo metoxi anteriormente mencionado y, por tanto, el subproducto propuesto (ver Figura 4) corresponde, concretamente, a la dihidroxibenzofenona o DHB anteriormente mencionada.
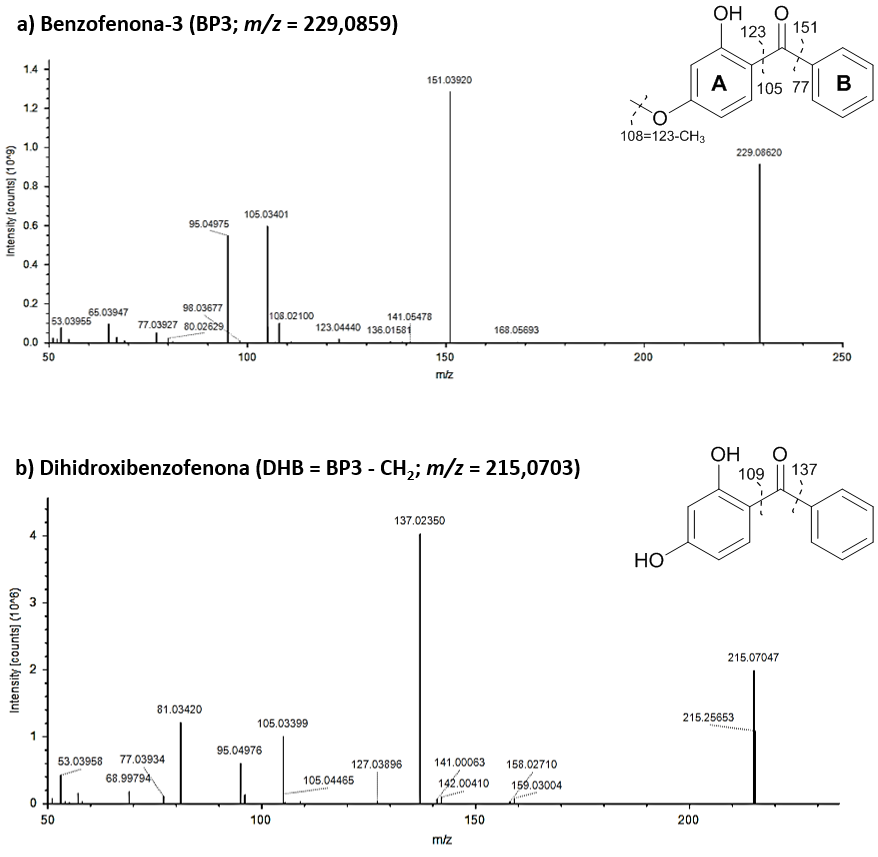
Y repitiendo este procedimiento, se pueden determinar hasta 18 subproductos diferentes de BP3 en distintos tejidos de dorada y en el agua de mar que es su hábitat (ver Figura 5). De todos ellos caben destacar la dihidroxibenzofenona (DHB) y la dihidroximetoxibenzofenona (DHMB) que dada la estrogenicidad y androgenicidad que presentan pueden ser incluso más tóxicas que BP3. Por tanto, es imprescindible identificar los subproductos nuevos para poder posteriormente estudiar su toxicidad y evaluar el riesgo medioambiental que suponen.

Tal y como hemos visto, con la espectrometría de masas como compañera de viaje, el submarinista tiene la oportunidad de obtener una foto más completa de lo que se ve y de lo que está oculto. El avance de la química, y de la ciencia en general, nos permite sumergirnos en retos mayores para obtener una foto más definida de lo que nos rodea, pasando de la identificación de cientos o miles de compuestos a la de millones.
Para saber más:
Kepner, W. 2016. EPA and a Brief History of Environmental Law in the United States. International Visitor Leadership Program (IVLP), Las Vegas, NV.
Kim S, Choi K. 2014. Occurrences, toxicities, and ecological risks of benzophenone-3, a common component of organic sunscreen products: A mini-review. Environ. Int. 70:143–157.
Ziarrusta H, Mijangos L, Montes R, Rodil R, Anakabe E, Izagirre U, Prieto A, Etxebarria N, Olivares M, Zuloaga O. 2018. Study of bioconcentration of oxybenzone in gilt-head bream and characterization of its by-products. Chemosphere. 208:399-407.
Milman B.L, Zhurkovich I.K. 2017. The chemical space for non-target analysis. Tr. Anal. Chem. 97: 179-187.
Milman B. 2015. General principles of identification by mass spectrometry. Tr. Anal Chem. 69: 24-33.
Sobre las autoras: Haizea Ziarrusta, Maitane Olivares y Olatz Zuloaga. Departamento de Química Analítica Facultad de Ciencia y Tecnología de la UPV/EHU y Estación Marina de Plentzia (UPV/EHU).


¿Quién se encuentra en el lado oculto del iceberg? |
[…] artículo ¿Quién se encuentra en el lado oculto del iceberg? de Haizea Ziarrusta, Maitane Olivares y Olatz Zuloaga (Departamento de Química Analítica Facultad […]
Understanding Unseen Struggles: Lead with Empathy
[…] framework I find helpful is the Iceberg Model from systems thinking. Only a small slice of any person’s story is visible; most of it—like an […]
Understanding Unseen Struggles: Lead with Empathy
[…] A helpful mental model here is the iceberg illusion. What we notice—like the tip of an iceberg—is just a fraction of someone’s real experience. Most of their setbacks, challenges, and moments of growth are submerged below the waterline, quietly shaping who they are. Image Source: ¿Quién se encuentra en el lado oculto del iceberg? […]