La tabla periódica en el arte: ¿Qué átomos hay en una obra?
Hace 150 años un ruso de prominente barba llamado Dmitri Ivánovich Mendeléyev propuso un elegante sistema para ordenar los elementos químicos en función de su peso atómico y sus propiedades químicas. Su trabajo sigue ofreciendo hoy un marco común en el ámbito de la Química y, no en vano, 2019 ha sido declarado el Año Internacional de la Tabla Periódica. Esta sección del Cuaderno de la Cátedra Científica se quiere unir a tan especial celebración y para ello, a lo largo de este año, haremos un recorrido por los elementos químicos que mayor importancia han tenido en la Historia del Arte. No olvidemos que conocer la composición química de los materiales artísticos es vital tanto para el proceso creativo como para la conservación y restauración de nuestro patrimonio cultural. Pero, antes de entrar de lleno con la tabla periódica, dedicaremos este artículo a una pregunta de vital importancia: ¿Cómo podemos saber qué elementos químicos hay en una obra de arte?

En entradas anteriores hemos hablado largo y tendido sobre numerosas técnicas analíticas que nos ayudan a conocer la composición química de los materiales artísticos. Hoy nos detendremos en una que, de una manera relativamente sencilla, nos permite saber qué tipo de átomos forman una obra de arte: la fluorescencia de rayos X. Es importante recalcar que esta técnica no nos ofrecerá una fórmula molecular exacta de una sustancia, tan solo nos dará información sobre los átomos que la forman. Por ejemplo, en una pintura que contenga amarillo de Nápoles, no nos revelará que la composición química es Pb2Sb2O7, pero sí que nos desvelará que hay plomo (Pb) y antimonio (Sb). En muchas ocasiones eso es más que suficiente para descifrar qué compuesto químico tenemos entre manos. Veamos brevemente en qué consiste la fluorescencia de rayos X antes de conocer algunas de sus aplicaciones en el mundo del arte.
De electrones y rayos X
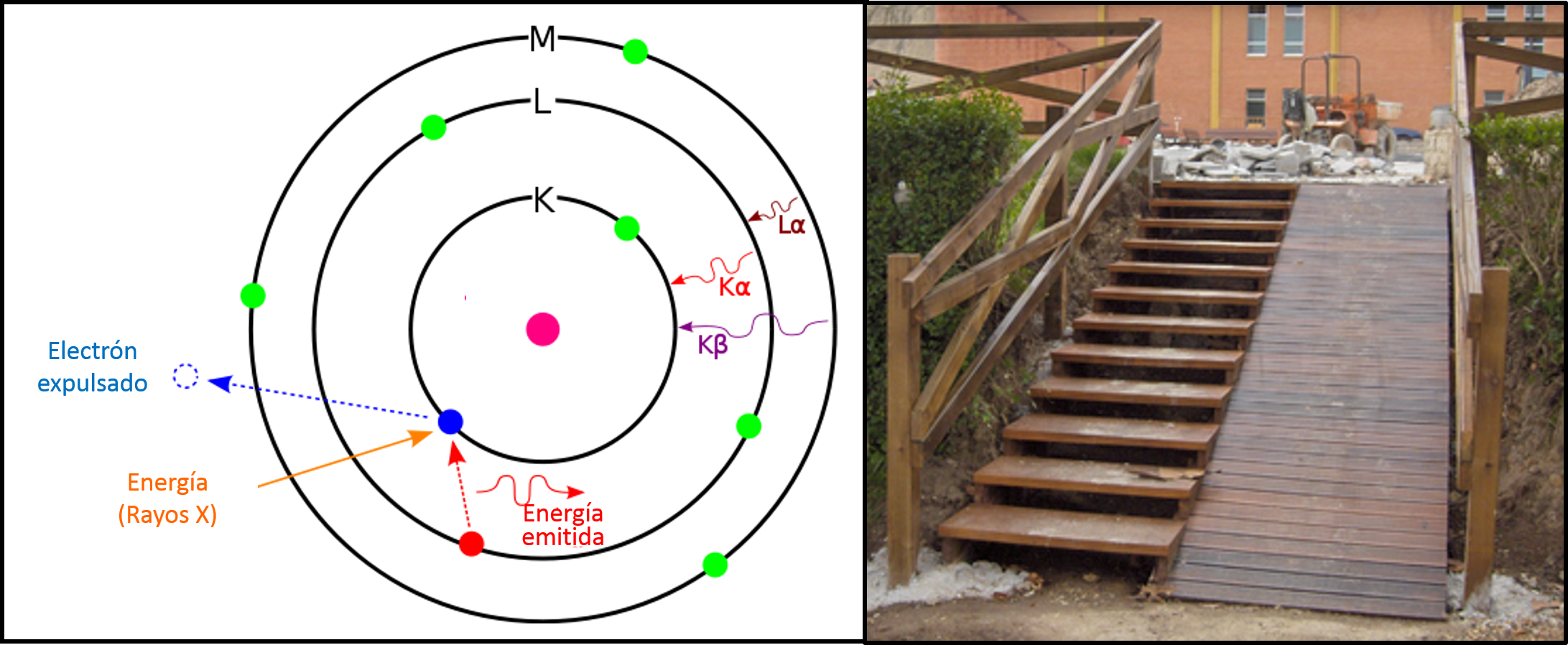
La fluorescencia de rayos X se basa en la interacción de la materia con una radiación como los rayos X o los rayos gamma. En la Imagen 2 (izquierda) vemos una representación esquemática del proceso que nos ayuda a descubrir la identidad de los átomos de una muestra (aunque la realidad de los orbitales difiere bastante de la de ese modelo planetario). Empleando una radiación de alta energía se expulsa un electrón de un orbital cercano al núcleo, es decir, un electrón de un nivel energético bajo. Esto provoca que un electrón de un nivel energético superior ocupe esta “vacante”, ya que el átomo tiende a minimizar su energía. En ese proceso el exceso de energía se libera también en modo de radiación (rayos X). Y, precisamente, esta radiación liberada es la clave que nos permite descubrir de qué elemento químico se trata. Esto es posible gracias a que los electrones sólo pueden tener ciertos valores de energía concretos que variarán en función del átomo y del orbital que ocupen. Haremos otra simplificación valiéndonos de nuevo de la Imagen 2 (derecha). Según la física clásica un electrón podría tener cualquier valor energético (podría estar en cualquier punto de la rampa), pero gracias a la mecánica cuántica sabemos que sólo puede tener unos valores discretos (los escalones). Al pasar de un nivel energético a otro (pasar de un escalón a otro), se libera una energía característica que nos permite conocer que elemento químico estamos analizando (la altura entre escalones depende del átomo). La fluorescencia de rayos X se puede aplicar a la mayoría de los elementos que forman la tabla periódica, con excepción de los que tienen un número atómico menor que el sodio (carbono, oxígeno, etc.) que son difíciles de detectar, especialmente con los instrumentos portátiles.
De átomos y colores
Ahora ya sabemos que la fluorescencia de rayos X nos descubre los elementos químicos presentes en una obra de arte, gracias a lo cual podemos deducir su composición química empleando ciertos conocimientos sobre materiales artísticos. Por ejemplo, si analizásemos la cerámica griega de figuras negras de la Imagen 3 detectaríamos hierro por toda la superficie. ¿Significaría eso que está formada por un solo tipo de compuesto químico? En tal caso sería difícil explicar la existencia de dos colores. La realidad es que las zonas rojizas están compuestas por hematita (Fe2O3) y las negras por magnetita (Fe3O4), colores que los griegos lograban mediante una hábil combinación de reacciones de oxidación y de reducción del hierro presente en la arcilla.

Obviamente, identificar los compuestos no siempre es tan sencillo como hemos visto en este caso. A alguien ya se le habrá ocurrido que la fluorescencia de rayos X ofrece ciertas limitaciones a la hora de discernir la composición química exacta y diferenciar entre sustancias. Efectivamente, podría darse el caso en que dos pigmentos que tengan el mismo color estén compuestos por los mismos elementos químicos, pero en diferentes proporciones. Por ejemplo, si en una pintura verde se detecta cobre, podría estar formada por malaquita (Cu2CO3(OH)2) o por verdigrís (Cu(CH3COO)2). Afortunadamente esos casos no son tan abundantes, ya que la química de los pigmentos no es tan compleja como podríamos pensar, especialmente si nos referimos a las pinturas que se empleaban antes de la aparición de la síntesis orgánica. Además, cuando se detectan varios elementos químicos en una muestra la cosa se puede simplificar. Para entender esto mejor, pongamos que en otra pintura verde detectamos cromo. Bien podría tratarse de un óxido de cromo (Cr2O3·2H2O) o de una combinación de amarillo de cromo (PbCrO4) y otro pigmento azul como el azul cobalto (CoO·Al2O3). ¿Cómo diferenciarlos? Pues, porque de darse la segunda opción, también encontraríamos cobalto (del azul) y plomo (del amarillo). En este último caso no habría que sacar conclusiones precipitadas, ya que el plomo también podría venir del blanco de plomo, tan empleado históricamente en mezclas de pinturas y preparaciones de soportes.
De pigmentos que (casi) se pierden
Una de las grandes ventajas de la fluorescencia de rayos X es que nos permite trabajar con rastros mínimos de pintura. Así, podremos conocer los pigmentos empleados en esculturas que hayan perdido la mayoría de su policromía. Dos casos célebres que reflejan este uso son la columna de Trajano (de la que ya hablamos en su momento) y la Dama de Elche. Gracias a los análisis realizados sobre la más famosa de las esculturas iberas, conocemos los pigmentos que una vez le dieron color (sí, estaba pintada), información que se ha empleado para realizar diferentes reconstrucciones (Imagen 4). Quizás lo más llamativo de este estudio es la presencia de azul egipcio (CuAlSi4O10), que refleja el intercambio cultural entre los iberos y el país del Nilo.

Un caso mucho más reciente de identificación de pigmentos lo encontramos en “El jardín de Daubigny” de Vincent van Gogh. Aunque en este caso la pintura no estaba perdida, sino oculta. Durante los últimos meses de vida el genio holandés pintó tres versiones de este jardín, entre ellas las dos que podéis observar en la Imagen 5. Como veis, hay claras diferencias compositivas entre las que destaca la presencia de un gato en la versión superior. Si observamos la misma zona en el otro cuadro podremos observar que van Gogh sepultó al gato con pinceladas de hierba. Pues bien, dicha zona se analizó mediante fluorescencia de rayos X y se encontró hierro y cromo, lo que permite pensar que el gato había sido pintado con una mezcla de amarillo de cromo (PbCrO4) y azul de Prusia (Fe7C18N18).

De mapas de pigmentos
La fluorescencia de rayos X no se limita al estudio de un solo punto de una obra de arte, sino que permite analizar toda la superficie para obtener una especie de mapas de abundancia de elementos químicos. Un ejemplo perfecto es el de La Joven de la Perla (Imagen 6). En la imagen vemos mapeo del mercurio en blanco y negro, de modo que las zonas más blancas indican una mayor cantidad de este elemento. El mercurio proviene del uso que Vermeer hizo del pigmento bermellón (HgS) que, como vemos, abunda en los labios de la muchacha. También podemos observar la presencia de mercurio en el rostro de la joven, aunque con una menor intensidad. En cambio, el turbante y el fondo son completamente oscuros. La explicación es simple: Vermeer empleó bermellón para ajustar la tonalidad que deseaba lograr en la pintura con la que pintó la cara.

Aunque la última imagen que os he mostrado está en blanco y negro, estos mapeos se obtienen empleando programas informáticos que permiten lograr resultados mucho más visuales. Esto lo ilustra perfectamente el mapeo de pigmentos del manuscrito tibetano que tenéis en la Imagen 7. Sabiendo qué elementos abundan en cada zona no es complicado saber que pigmentos fueron usados: bermellón (HgS) para el borde rojo, pan de oro (Au) para la piel y la mandorla, minio (Pb3O4) para el traje, y compuestos con cobre para los azules y los verdes, posiblemente azurita (Cu3(CO3)2(OH)2) y malaquita (Cu2CO3(OH)2) respectivamente.

Con este artículo hemos realizado un primer acercamiento a la tabla periódica desde el punto de vista de los materiales artísticos. A lo largo de este año iremos profundizando en aquellos elementos químicos que mayor trascendencia han tenido a lo largo de la historia del arte. ¡No os lo perdáis!
Para saber más:
Simon Fitzgerald. Non-destructive micro-analysis of Art and Archaeological objects using micro-XRF [PDF]. Acheometriai Műhely 2008/3.
Sobre el autor: Oskar González es profesor en la facultad de Ciencia y Tecnología y en la facultad de Bellas Artes de la UPV/EHU.

Lo Mejor de la Semana (24 de febrero – 2 de marzo) | Hablando de Ciencia
[…] Por medio de la fluorescencia de rayos X se pueden detectar los átomos que componen una obra de arte. En el Cuaderno de Cultura Científica nos lo explican. […]
La tabla periódica en el arte: ¿Q…
[…] Hace 150 años un ruso de prominente barba llamado Dmitri Ivánovich Mendeléyev propuso un elegante sistema para ordenar los elementos químicos en función de su peso atómico y sus propiedades químicas. Su trabajo sigue ofreciendo hoy un marco común en el ámbito de la Química y, no en vano, 2019 ha sido declarado el Año Internacional de la Tabla Periódica. […]