Las transmutaciones de van Helmont (2)

La teoría química de van Helmont es una mezcla muy curiosa de lo más avanzado con lo más arcaico. Muchos en el siglo XVII aceptaban como transmutación el hecho de que los metales se disolviesen en ácido; obviamente, el concepto de moderno de disolución no estaba establecido. También se aceptaba como transmutación el hecho de que una herradura de hierro dejada en un arroyo cercano a minas de cobre (y, por tanto, rico en sales de cobre disueltas) terminase recubierto por una capa de cobre. Sin embargo, para van Helmont estos dos fenómenos claramente no eran transmutaciones, pero eso no impedía que siguiese creyendo en la posibilidad.
De hecho, dejó escrito una anotación en la que relataba lo que el creía sinceramente que había sido una transmutación de 8 onzas de mercurio en oro conseguida mediante la adición de un cuarto de grano (el grano era una medida de peso equivalente al peso medio de un grano de trigo, equivalente a 0,0648 g) de un polvo amarillo suministrado por un extraño (véase el paralelismo con la presunta transmutación de Helvetius).
Es difícil saber con los datos proporcionados qué presenció van Helmont en realidad. El mercurio es conocido por su capacidad para combinarse formando amalgamas y compuestos, por lo que podría haber incorporado algún tipo de material de color amarillo metálico y volverse sólido al hacerlo. Con todo, no es fácil encontrar algún producto que tenga ese efecto en unas cantidades tan pequeñas para 8 onzas de mercurio. Pero recordemos que en esta época los alquimistas estafadores se habían vuelto realmente sofisticados y, por ejemplo, nada impide que el extraño no solo diese el polvo amarillo sino que lo entregase en un recipiente en el que debía realizarse la mezcla para que no se perdiese parte en el trasvase, y que fuese este recipiente el que aportase realmente la parte que efectivamente hacía que la reacción ocurriese.
Y así van Helmont osciló entre revolucionario y reaccionario toda su vida. Rechazó los cuatro elementos aristotélicos (jugándose, literalmente, el cuello) y los tres principios de Paracelso, pero los reemplazó por aire y agua, señalando la creación de los cielos y el agua en el segundo día del Génesis como fundamento. El aire era solamente un medio físico, por lo que , en última instancia, todo se reducía a agua. Pero, por otro lado, hizo un uso intensivo de la balanza y como consecuencia de él llegó al convencimiento de que nada se crea o se destruye en una reacción química (la ley de conservación de la materia es anterior a Lomonósov o Lavoisier), aunque no lo expresó explícitamente.
Su famoso experimento del sauce ilustra perfectamente sus planteamientos y, significativamente, el tipo de experimentación que llevaría en última instancia al surgimiento de la química como ciencia. En este experimento pesó una plántula de sauce y la sembró en una cuba con exactamente 200 libras de tierra previamente desecada; cubrió la cuba para impedir que el polvo o cualquier otra cosa se añadiese a la tierra. Después de regarla con agua destilada y verla crecer durante 5 años, sacó el pequeño sauce de la tierra con gran cuidado y lo volvió a pesar. Encontró que el árbol había incrementado su peso sustancialmente pero que la tierra pesaba muy poco menos de 200 libras. Hasta aquí el experimento y los datos. Su interpretación es otra cosa. De ellos van Helmont extrajo la conclusión de que el agua aportada se había convertido en madera de sauce.
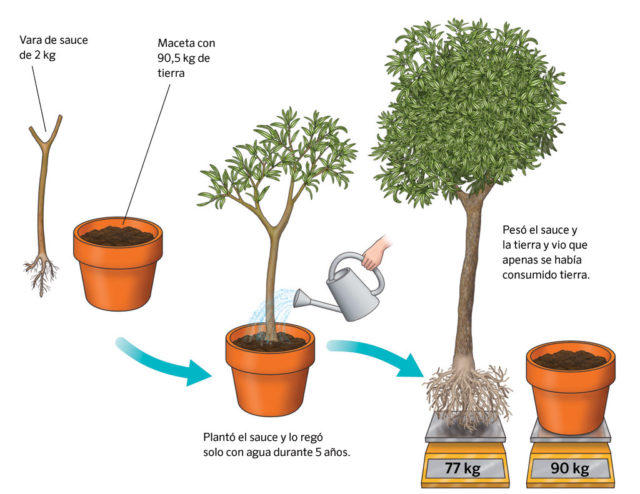
Obviamente el experimento carece de otros controles mínimos, como llevar un registro del peso de agua aportada, de las pérdidas por evaporación o filtrado fuera de la cuba o posibles derrames. Ni que decir tiene que van Helmont no tenía idea del papel que juega el dióxido de carbono del aire en la biología de la planta, ni de que ésta emitía oxígeno. Pero la idea básica está ahí: la cantidad de materia hay que controlarla con la balanza. Lo que fuese que se introdujese en una reacción tenía que aparecer en los resultados de una forma u otra.
Sobre el autor: César Tomé López es divulgador científico y editor de Mapping Ignorance

Los cimientos de la química neumática al estilo van Helmont (y 3) – Cuaderno de Cultura Científica
[…] principio de conservación de la materia es algo que está implícito en van Helmont ya que asume en sus experimentos que se conserva independientemente de los cambios que sufra. […]