Los experimentos de Joule
Cerca de medio siglo después James Prescott Joule repetiría los experimentos de Rumford a una escala menor. Comenzó en los años cuarenta del siglo XIX y los repitió durante muchos años, refinando cada vez más sus aparatos y sus técnicas. En todos los casos, cuanto más cuidadoso era más exacta encontraba la proporcionalidad de la cantidad de calor, medida como cambio en la temperatura y la cantidad de trabajo realizado. Como Joule hacía sus experimentos con agua, como el resto de investigadores de la época, asumía que la proporcionalidad que encontraba entre la cantidad de calor producida, simbolizada por la letra Q (Q es un símbolo habitual para el calor) era igual a la cantidad de agua expresada como su masa, m, multiplicada por el cambio (que se simboliza con la letra griega Δ, delta) de la temperatura, T; con lo que llegaba a la expresión: Q = m·ΔT.
Hoy sabemos que la cantidad de calor que corresponde a un determinado cambio de temperatura es diferente para diferentes sustancias (incluso que puede variar con la temperatura). Para tener esto en cuenta en la expresión anetrior basta con introducir una constante c, a la llamaremos calor específico de la sustancia en cuestión. Así, la relación entre calor y cambio de temperatura puede escribirse como: Q = m·c·ΔT.
La cantidad de calor puede expresarse en una unidad llamada caloría. La caloría se define como la cantidad de calor que se requiere para elevar la temperatura de 1 g de agua 1 ºC en condiciones estándar. De aquí que el calor específico del agua expresado en calorías sea exactamente 1, es decir, para el agua c = 1 cal /gºC. Por tanto, si estamos hablando en estas unidades, se cumple la relación de Joule: Q = m·ΔT

Joule realizó experimentos muy variados y empleando medios diferentes para poder establecer una relación independientemente del sistema empleado.
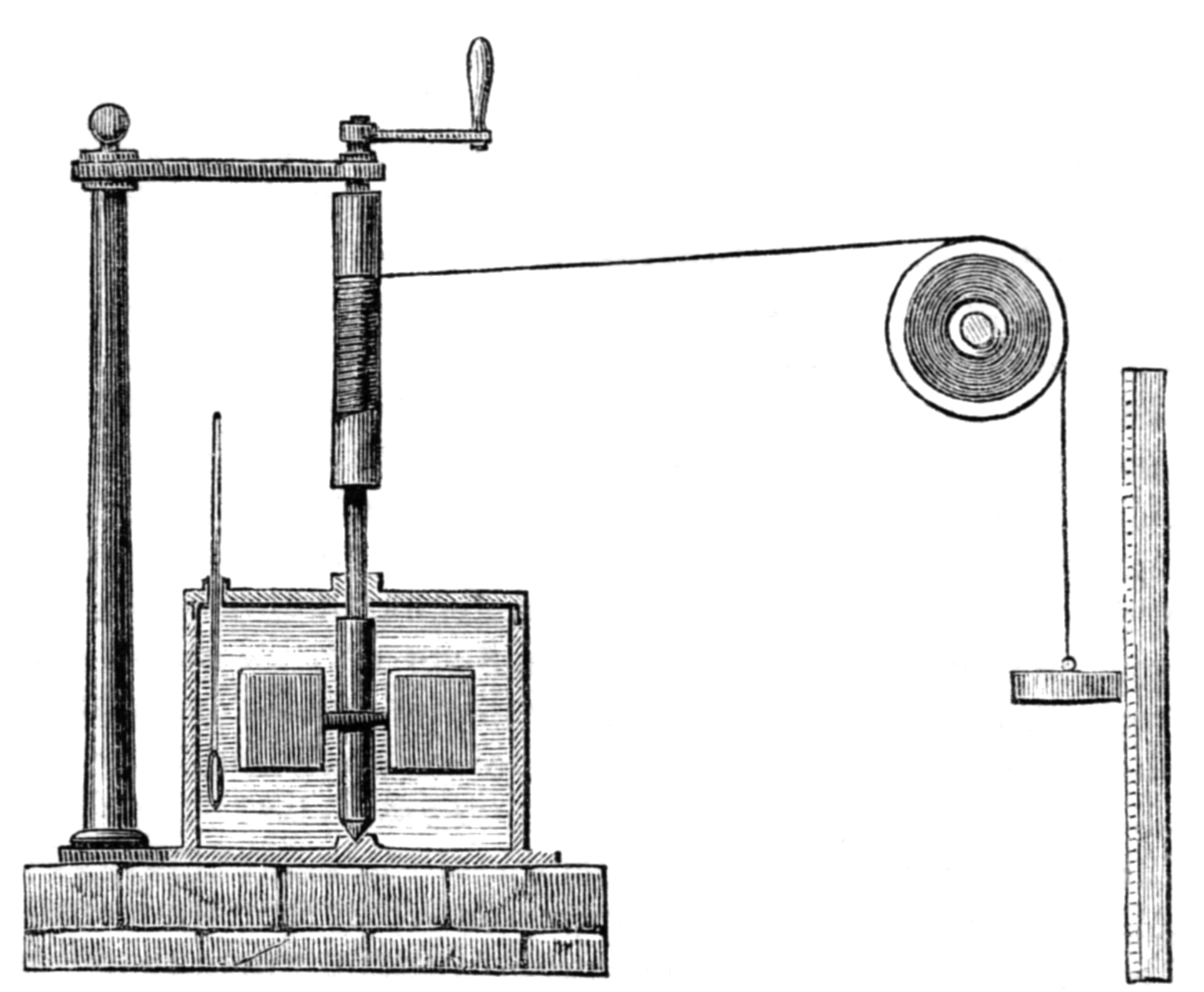
Para uno de sus primeros experimentos sobre la relación entre calor y trabajo Joule construyó un generador eléctrico sencillo, cuya fuerza motriz era un peso que dejaba caer. Hacía pasar la corriente eléctrica generada así por un cable que estaba sumergido en un contenedor con agua, a la que calentaba. A partir de la distancia que recorría el peso al caer Joule podía calcular el trabajo realizado (recordemos que el trabajo no es más que la fuerza por la distancia, y el peso es una fuerza; también es en este caso, una disminución de la energía potencial, esa que está relacionada con la posición en un campo como el gravitatorio). El producto de la masa de agua, m, en el contenedor por el aumento de su temperatura, ΔT, le permitió a Joule calcular la cantidad de calor producida, Q.
En otro experimento Joule comprimía gas en una botella sumergida en agua, miediendo el trabajo hecho para comprimir el gas por el pistón. Medía después la cantidad de calor aportada al agua por el calentamiento del gas al comprimirse.
Probablemente la serie de experimentos más famosa es aquella que empleaba un aparato en el que unos pesos que descendían lentamente hacían girar una rueda de paletas en un contenedor de agua. Debido a la fricción enre la rueda y el líquido, la rueda realizaba trabajo sobre el líquido, aumentando su temperatura.
Todos estos experimentos, algunos repetidos muchas veces con aparatos cada vez mejores, llevaron a Joule a enunciar dos resultados cuantitativos muy importantes en 1849 que, expresados en lenguaje actual, son:
- La cantidad de calor producida por la fricción de los cuerpos, ya sean sólidos o líquidos, es siempre proporcional a la cantidad de energía gastada.
- La cantidad de calor (en calorías) capaz de incrementar la temperatura de 1 kg de agua en 1 ºC requiere el cambio en la energía mecánica representada por la caída de 1 m de un peso de 4.180 N (newtons)
La primera afirmación de Joule es la prueba de que el calor es una forma de energía, en contra de la teoría del calórico de que el calor es un fluido. La segunda da la magnitud numérica de la proporción que había encontrado entre energía mecánica y su energía térmica equivalente. Esta proporción entre energía mecánica, E, y la cantidad equivalente de energía térmica, Q, se llama habitualmente equivalente mecánico del calor. A principios de del siglo XX su valor numérico quedaría establecido en 4,186 J/cal (julios, la unidad de energía, por caloría).
En la época en la que joule realizó sus famosos experimentos, la idea de que el calor es una forma de energía estaba ganando aceptación. Si bien Joule no fue el único en expresar estas ideas, sus experimentos fueron clave para su consolidación.
Sobre el autor: César Tomé López es divulgador científico y editor de Mapping Ignorance
Se establece el principio de conservación de la energía – Cuaderno de Cultura Científica
[…] los más conocidos. Se publicó en 1847, dos años antes de que Joule publicase los resultados de sus experimentos más precisos. El autor, un joven médico alemán que estaba estudiando el metabolismo del músculo […]
Una cuestión de movimiento – Cuaderno de Cultura Científica
[…] que el calor no es una sustancia sino una forma de energía que puede convertirse en otras formas. James Prescott Joule y Rudolf Clausius fueron un paso más allá. El calor puede producir energía mecánica, y la […]
Yennys aldana
El calor no es una sustancia sino una forma de energía que puede convertirse en otras formas.
El misterio de la temperatura constante — Cuaderno de Cultura Científica
[…] energía como calor. A medida que el agua se enfría, la variación de su temperatura, ΔT, está relacionada con la cantidad de la energía neta transferida como calor, ΔQ, por la relación ΔQ = m·c·ΔT , donde m es la masa de agua y c es el calor específico del agua […]