Carnot fue uno de de los ingenieros franceses que se propusieron estudiar los principios científicos subyacentes al funcionamiento de la máquina de vapor con el objetivo de lograr la máxima potencia de salida con la máxima eficiencia. Como resultado de sus estudios, Carnot y otros ayudaron a establecer la física del calor, lo que se conoce como termodinámica.

Carnot comenzó con la observación experimental de que el calor no fluye por sí solo de un cuerpo frío a uno caliente. Se deduce entonces que si, en una situación dada, se hace fluir calor de lo frío a lo caliente, debe tener lugar algún otro cambio en otra parte. Es decir, debe realizarse algún trabajo. Por ejemplo, un refrigerador o un acondicionador de aire son también «máquinas térmicas», pero su ciclo funciona de manera inversa a una máquina de vapor o un motor de automóvil. Hace falta trabajo (en forma de energía eléctrica o mecánica) para bombear el calor de un cuerpo frío (desde el interior del compartimento o la habitación fríos) a uno más caliente (la habitación donde está el refrigerador o el aire exterior). Utilizando una argumentación muy elegante1 Carnot demostró que ninguna máquina puede ser más eficiente que una máquina ideal y reversible, y que todas las máquinas de este tipo tienen la misma eficiencia.
¿Y que es una máquina ideal y reversible? De entrada algo que no existe en el mundo real (por eso se llama ideal), pero que es extremadamente útil para entender los límites de las máquinas reales. Íntimamente ligado a la idealidad está el concepto de reversibilidad. Una máquina reversible es aquella en la que el ciclo desde la energía de entrada al trabajo de salida más la energía residual, y vuelta a la energía de entrada, se puede ejecutar en sentido inverso sin ninguna pérdida o ganancia adicional de calor u otras formas de energía.
Como todas las máquinas reversibles tienen la misma eficiencia, sólo se tiene que elegir una versión simple de una máquina reversible y calcular su eficiencia para un ciclo para encontrar un límite superior a la eficiencia de cualquier máquina. Esta máquina simple se representa esquemáticamente en el siguiente diagrama. Durante un ciclo de funcionamiento, la máquina, representada por la C de Carnot, absorbe la energía térmica Q1 del cuerpo caliente a temperatura T1, produce un trabajo útil W, y descarga una cierta cantidad de energía térmica Q2 al cuerpo frío a temperatura T2. El ciclo puede repetirse muchas veces.
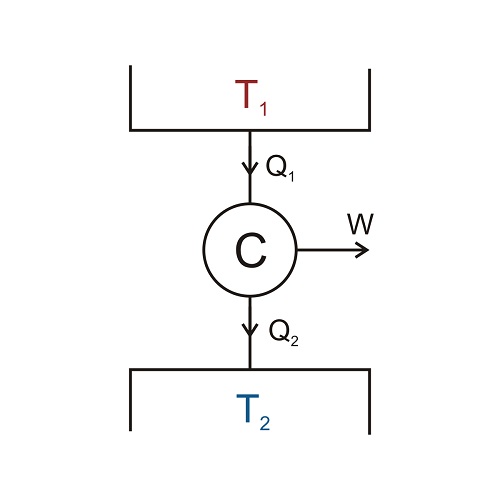
Observando el diagrama y empleando la ley de conservación de la energía vemos que se tiene que cumplir que Q2 = Q1 – W; o, dicho en términos coloquiales, el calor que sale es la diferencia entre el que entra menos el trabajo que realiza la máquina. Pero, como la eficiencia vimos que era la proporción entre la energía de salida (ahora añadimos “útil”, esto es, el trabajo) y la energía de entrada, tenemos que ef = W/Q1.
Carnot calculó la eficiencia de este ciclo esquemático y encontró que las proporciones de calor y trabajo en una máquina reversible dependen solamente de la temperatura2 de la sustancia caliente desde la cual la máquina obtiene el calor y la temperatura2 de la sustancia fría que extrae el calor residual de la máquina.
La expresión que encontró Carnot para la eficiencia de las máquinas reversibles es, escrita con nomenclatura actual, ef = W/Q1 = 1 – T2/T1
Démonos cuenta de que la única forma de obtener una eficiencia del 100%, es decir ef = 1, es si hacemos que T2, la temperatura de la sustancia que recibe el calor residual, sea el cero absoluto, algo físicamente imposible, como veremos. Esto significa, de nuevo en términos coloquiales, que toda máquina debe liberar algo de calor residual al exterior antes de volver a tomar más energía del cuerpo caliente. Y esto, tan simple, es de una importancia enorme.
Notas:
1 Una argumentación a la que, por su simplicidad, importancia y valor formativo, dedicaremos una anotación específica.
2 Las temperaturas usadas en este caso se llaman temperaturas absolutas (T), o Kelvin, (por el señor Kelvin que fue el primero en introducir esta escala). En la escala absoluta, las mediciones de temperatura son iguales a las temperaturas (t) en la escala Celsius (°C) más 273. No se usa signo de grado, °, para grados Kelvin, el símbolo utilizado es K. Por tanto, el agua se congela a T = 273 K y cuando T = 0 K hablamos de cero absoluto. Ya explicaremos el origen de esta escala más adelante en la serie.
Sobre el autor: César Tomé López es divulgador científico y editor de Mapping Ignorance

Carnot y los comienzos de la termodinámica (2) – Cuaderno de Cultura Científica
[…] máquina ideal de Carnot, tan sencilla como es, explica algunos aspectos fundamentales del funcionamiento de máquinas y […]