Tras exponer nuestro modelo simple del gas ideal, incorporar la distribución de las velocidades de las moléculas de Maxwell y tener en cuenta el efecto del tamaño de las moléculas, ya lo tenemos todo para ver cómo se deriva a partir del modelo cinético una ley a la que se ha llegado por estudios macroscópicos y fenomenológicos, la ley del gas ideal.
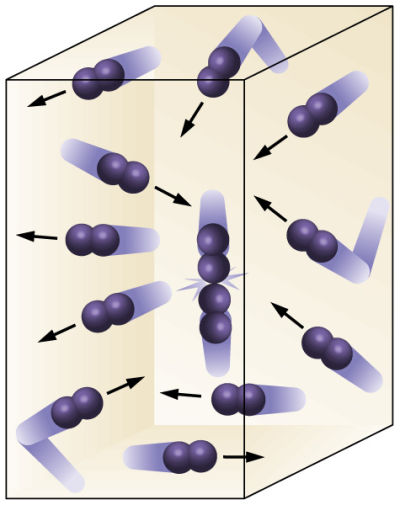
Según estableció Bernoulli, en la teoría cinética la presión de un gas es el resultado de los impactos contínuos de las partículas del gas contra las paredes del contenedor. Esto explica por qué la presión es inversamente proporcional al volumen (ley de Boyle) y directamete proporcional a la densidad: cuanto más pequeño sea el volumen o mayor la densidad, mayor será el número de partículas que colisionan con la pared en un momento dado. Pero la presión tambien depende de la energía cinética de las partículas (Ec)y, por tanto, de su velocidad, v, ya que Ec = 1/2 m·v2. Esta velocidad determina no solo la fuerza que se ejerce sobre la pared durante cada impacto, sino también la frecuencia de estos impactos.
Si las colisiones con la pared son perfectamente elásticas, la ley de conservación del momento lineal describe perfectamente el resultado del impacto. Un átomo que rebota e una pared sufre un cambio de momento lineal. Como el momento lineal es el producto de la masa por la velocidad, este cambio de momento se traduce en un cambio de velocidad, ya que asumimos que la masa es constante para la partícula (aquí habría que recordar que la velocidad es un vector). Pero si hay un cambio de momento lineal es porque se ha ejercido una fuerza sobre la partícula durante el impacto, como sabemos por las leyes de Newton. Por estas mismas leyes, para esa fuerza que ha hecho rebotar a la molécula de gas debe existir una fuerza de reacción que se aplica sobre la pared: esta fuerza es la contribución del impacto de la partícula a la presión.
Aplicando las mecánica de Newton a nuestro odelo simple de gas llegamos a la conclusión, para las tres dimensiones del movimiento, de que la presión P está relacionada con el promedio de la velocidad de los átomos al cuadrado, (v2)pr, y con el volumen, V, y la masa de la molécula de gas, m, según la expresión P = m· (v2)pr / 3V.
La derivación de esta expresión es muy sencilla y un magnífico ejemplo de la aplicación de las leyes de Newton en un dominio en el que el propio Newton no se aventuró.
Tenemos ahora dos expresiones para la presión de un gas. Una derivada de datos experimentales macroscópicos, P· V = k ·T y otra derivada de las leyes de Newton aplicadas a nuesto modelo simple, P = m· (v2)pr / 3V. Si ambas describen la misma realidad, entonces debe ocurrir que k · T = m · (v2)pr / 3. De aquí se deduce que la temperatura, T = 2/(3k) · m ·(v2)pr /2, es decir, la temperatura de un gas es proporcional a la energía cinética promedio de sus moléculas.
Ya teníamos alguna indicación de que aumentar la temperatura de un material afectaba de alguna manera al movimiento de sus “pequeños componentes”. También éramos conscientes de que cuanto mayor es la temperatura de un gas, más rápido se movían sus moléculas. La novedad es que ahora tenemos una relación cuantitativa precisa derivada del modelo cinético y de las leyes experimentales. Por fin podemos afirmar no solo que el calor no es algún tipo de fluido u otra sustancia, sino también que es solo la energía cinética de las partículas (átomos, moléculas) que constituyen el material*.
Nota:
* Para ser precisos, eso que estamos llamado calor, y que ya dejamos claro que es energía térmica, no solo es movimiento de las partículas, también es energía radiante. Pero baste esta forma de expresarse para los fines de esta serie.
Sobre el autor: César Tomé López es divulgador científico y editor de Mapping Ignorance

Otras predicciones del modelo cinético. Movimiento browniano – Cuaderno de Cultura Científica
[…] Nuestro modelo cinético para un gas permite realizar más predicciones cuantitativas interesantes además de la ley del gas ideal. […]