
El éxito más espectacular del modelo de Bohr fue que podía usarse para explicar todas las líneas de emisión (y absorción) en el espectro de hidrógeno; es decir, Bohr podía usar su modelo para derivar, y así explicar, la fórmula de Balmer para los espectros de hidrógeno.
Según el segundo postulado de Bohr, la radiación emitida o absorbida en una transición en un átomo debe tener una frecuencia determinada por hf = E1 – E2. Si nf es el número cuántico del estado final y ni es el número cuántico del estado inicial, entonces según el resultado para En: Ef = 1/nf2 · E1 y Ei = 1/ni2 · E1.
La frecuencia de la readiación emitida o absorbida cuando un átomo pasa del estado incial al final viene determinada por una relación muy simple que resulta de una manipulación muy sencilla de las igualdades anteriores:
hf = E1 · ( 1/ni2 – 1/nf2).
En la fórmula de Balmer aparecía la longitud de onda, no la frecuencia, por lo que usaremos la relación existente entre ambas variables. La frecuencia de una línea en el espectro es igual a la velocidad de la onda de luz dividida por su longitud de onda: f = c / λ. Sustituyendo f por c / λ en la última ecuación y luego dividiendo ambos lados por la constante hc (la constante de Planck multiplicada por la velocidad de la luz), obtenemos
1/λ = E1/ hc · ( 1/ni2 – 1/nf2).
Según el modelo de Bohr, entonces, esta ecuación proporciona la longitud de onda de la radiación emitida o absorbida cuando un átomo de hidrógeno cambia de un estado estacionario con número cuántico ni a otro con nf.
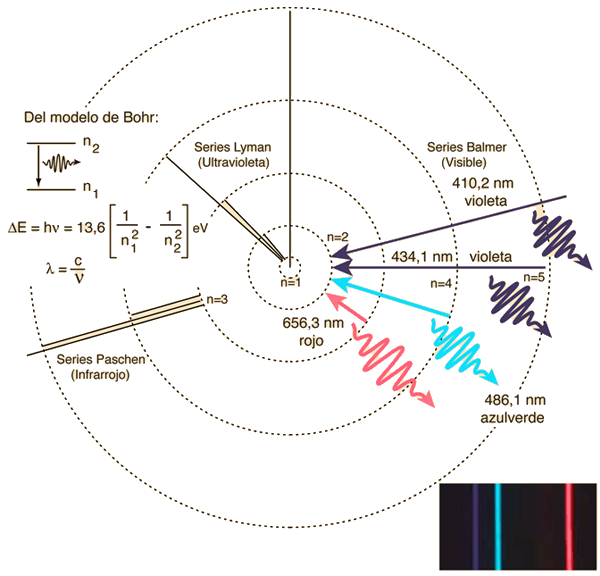
¿Cómo se compara esta predicción del modelo de Bohr con la firmemente establecida fórmula empírica Balmer para la serie Balmer? Esta es, por supuesto, la pregunta crucial. La fórmula de Balmer, como ya vimos, en términos modernos es
1/λ = RH (1/22 – 1/n2)
Basta fijarse un poco para darnos cuentas de que la ecuación para la longitud de onda emitida (o absorbida) derivada del modelo de Bohr es exactamente la fórmula de Balmer siempre que nf = 2 y RH = – E1/ hc [1].
La constante de Rydberg RH se conocía desde hacía mucho tiempo por mediciones espectroscópicas que tenía un valor de 1,097 ·107 m-1. Ahora solo quedaba compararla con el valor que toma – E1/ hc [2]. La coincidencia era extremadamente buena. RH, hasta ese momento considerada como una constante determinada experimentalmente, ahora se demostraba que era un número que podía calcularse a partir de constantes fundamentales conocidas de la naturaleza: la masa y la carga del electrón, la constante de Planck y la velocidad de la luz.
Y lo que es más importante, ahora puedes ver el significado, en términos físicos, de la fórmula empírica para las líneas en la serie Balmer. Todas las líneas de la serie Balmer simplemente corresponden a transiciones de varios estados iniciales (varios valores de ni mayores que 2) al mismo estado final, para el que nf = 2. Por lo tanto, los fotones que tienen la frecuencia o la longitud de onda de la línea Hα se emiten cuando los electrones en un gas de átomos de hidrógeno «saltan» del estado n = 3 al estado n = 2; la línea Hβ corresponde a «saltos» de n = 4 a n = 2, y así sucesivamente.
Notas:
[1] Ojo al signo negativo.
[2] Recordemos que E1 tiene un valor negativo, por lo que – E1 es positivo.
Sobre el autor: César Tomé López es divulgador científico y editor de Mapping Ignorance